nur für Forschungszwecke
Anisomycin (Flagecidin) Protein-Synthese-Inhibitor
Kat.-Nr.S7409
Chemische Struktur
Molekulargewicht: 265.3
Qualitätskontrolle
| Verwandte Ziele | ERK p38 MAPK Raf MEK Ras KRas S6 Kinase MAP4K TAK1 Mixed Lineage Kinase |
|---|---|
| Weitere JNK Inhibitoren | CC-90001 SP600125 JNK-IN-8 JNK Inhibitor IX Tanzisertib Hydrochloride (CC-930) JNK Inhibitor VIII Polyphyllin I DTP3 BI-78D3 Bentamapimod (AS602801) |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| HEK293 | Function assay | Inhibitory concentration required to produce cytotoxicity against HEK293 cells, IC50=0.02μM. | 16005213 | |||
| HeLa | Function assay | 10 uM | Inhibition of translation in human HeLa cells at 10 uM by 35S-methionine metabolic labeling study | 15165136 | ||
| HEK293 | Function assay | 100 uM | 15 mins | Increase of JNK phosphorylation in U50488 treated untransfected HEK293 cells at 100 uM after 15 mins | 17702750 | |
| HEK293 | Function assay | 50 uM | 15 mins | Increase of U50488-induced JNK phosphorylation in untransfected HEK293 cells at 50 uM after 15 mins | 17702750 | |
| RAW264.7 | Function assay | 5 uM | 30 mins | Activation of p38MAPK in mouse RAW264.7 cells assessed as phosphorylation at Thr180/Tyr182 at 5 uM after 30 mins by Western blotting analysis | 23294286 | |
| Sf9 | Function assay | 10 uM | 6 to 24 hr | Increase of ATP level in Spodoptera frugiperda (fall armyworm) Sf9 cells at 10 uM after 6 to 24 hr by luminescent cell viability assay | ChEMBL | |
| Sf9 | Cytotoxicity assay | 10 uM | 72 hr | Cytotoxicity against Spodoptera frugiperda (fall armyworm) Sf9 cells at 10 uM after 72 hr by trypan blue dye exclusion test | ChEMBL | |
| VERO-E6 | Function assay | 48 hrs | Determination of IC50 values for inhibition of SARS-CoV-2 induced cytotoxicity of VERO-E6 cells after 48 hours exposure to 0.01 MOI SARS CoV-2 virus by high content imaging, IC50=0.09μM. | ChEMBL | ||
| VERO-E6 | Function assay | 48 hrs | Toxicity CC50 against VERO-E6 cells determined at 48 hours by high content imaging (same conditions as 2_LEY without exposure to 0.01 MOI SARS CoV-2 virus), CC50=0.1μM. | ChEMBL | ||
| Vero E6 | Function assay | CC50 determination at MOI 0.004 using CellTiter- Glo (CTG) assay, performed 3 days post-infection in Vero E6 cells, CC50<0.39μM. | ChEMBL | |||
| Vero E6 | Function assay | CC50 determination at MOI 0.01 using CellTiter- Glo (CTG) assay, performed 3 days post-infection in Vero E6 cells, CC50<0.39μM. | ChEMBL | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 265.3 | Formel | C14H19NO4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 22862-76-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
Löslichkeit
|
In vitro |
DMSO
: 53 mg/mL
(199.77 mM)
Ethanol : 16 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
JNK
|
|---|---|
| In vitro |
Anisomycin (3 μM) verringert die Proteinsynthese in MDA16- und MDA-MB-468-Zellen und reduziert die Koloniebildung durch MDA-MB-468-Zellen. Diese Verbindung führt zu einer Zunahme der Anzahl apoptotischer Zellen in MDA-MB-468-Kulturen, jedoch nicht in MDA16-Kulturen. Es aktiviert die JNK-Phosphorylierung in MDA-MB-468-Zellen. In U251- und U87-Zellen hemmt diese Chemikalie (0,01-8 μM) das Zellwachstum in zeit- und konzentrationsabhängiger Weise mit den IC50-Werten (48 h) von 0,233 bzw. 0,192 μmol/L. Es (4 μM) verursacht 21,5 % und 25,3 % Apoptose in U251- bzw. U87-Zellen und aktiviert p38 MAPK und JNK, während ERK1/2 inaktiviert wird. Diese Verbindung (4 μM) reduziert den PP2A/C-Untereinheitspiegel in zeitabhängiger Weise in U251- und U87-Zellen. Es hemmt die EAC-Zellproliferation in konzentrationsabhängiger Weise.
|
| Kinase-Assay |
JNK-Phosphorylierung
|
|
500.000 Zellen/Well werden in 6-Well-Platten ausgesät und über Nacht inkubiert. Die Zellen werden dann 1 h lang mit Testverbindungen oder DMSO als Vehikelkontrolle (Endkonzentration 1 % v/v) inkubiert. Puromycin wird hinzugefügt (Endkonzentration 18 μM) und die Zellen weitere 10 min inkubiert, um neu entstehende Polypeptidketten zu markieren. Die Hintergrundmarkierung wird durch Inkubation von Zellen ohne Puromycin bestimmt. Die Zellen werden dann in HBSS gewaschen, durch Schaben geerntet und zentrifugiert (300 g, 5 min). Die Zellen werden in 0,5 mL 50 mM DTT, das Phosphataseinhibitoren enthält, resuspendiert und 10 min bei 95 °C inkubiert. Die Proben werden dann in flüssigem Stickstoff schockgefroren und bei -20 °C gelagert, bis sie geblottet werden. Proben (20–30 μg Protein/Probe) werden auf eine PVDF-Membran geblottet. Die Membran wird blockiert und über Nacht bei 4 °C mit einem Anti-phospho-Thr183/Tyr185-JNK-Antikörper inkubiert. Sekundärantikörper werden verwendet, um den primären Antikörper zu markieren und mit einem Infrarot-Scanner nachgewiesen. Die Intensität des Fluoreszenzsignals für den Anti-phospho-JNK-Antikörper wird hintergrundkorrigiert und für die Beladung normalisiert.
|
|
| In vivo |
Die peritumorale Verabreichung von Anisomycin (5 mg/kg) unterdrückt das Wachstum des Ehrlich-Ascites-Karzinoms (EAC) signifikant, was zum Überleben von etwa 60 % der Mäuse 90 Tage nach der EAC-Inokulation führt.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | p-Keratin 20 / Keratin 20 / p-Keratin 18 / Keratin 18 / p-Keratin 8 / Keratin 8 / p-MK2 / p-hHSPB1 / hHSPB1 PP2A / PP2C p-ERK / ERK / p-JNK / JNK / p-p38 / ATF3 |
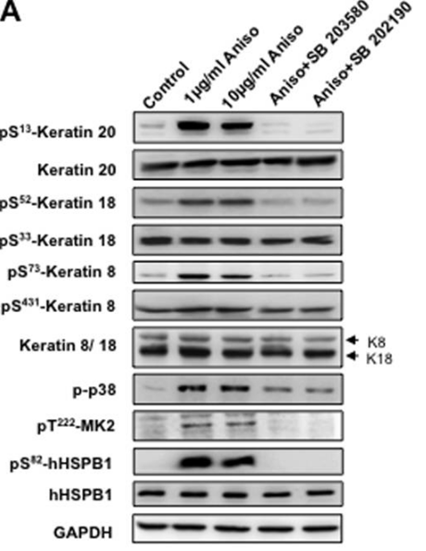
|
20724476 |
| Immunofluorescence | p-Keratin 8 / p-Keratin 18 / p-Keratin 20 |
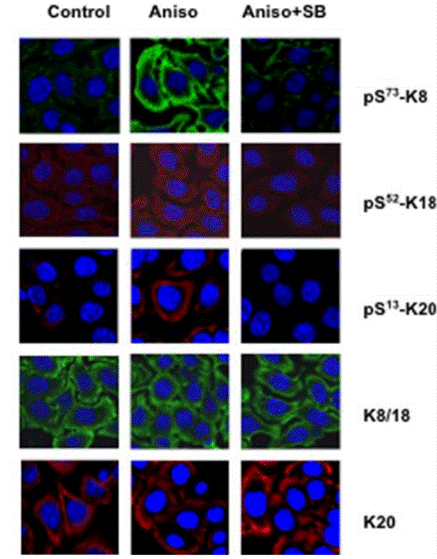
|
20724476 |
| Growth inhibition assay | Cell viability |
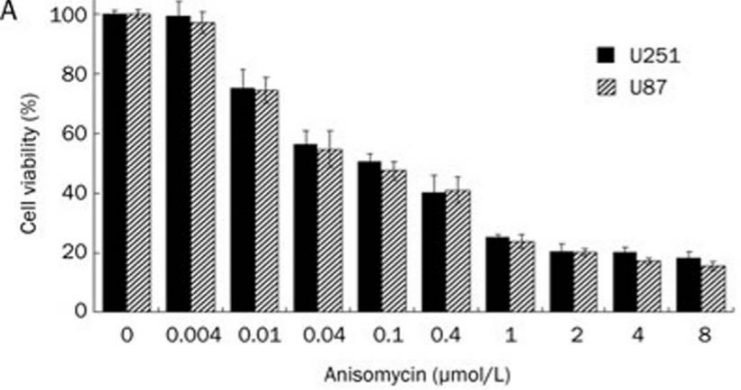
|
22684030 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
