nur für Forschungszwecke
SP600125 JNK Inhibitor
Kat.-Nr.S1460
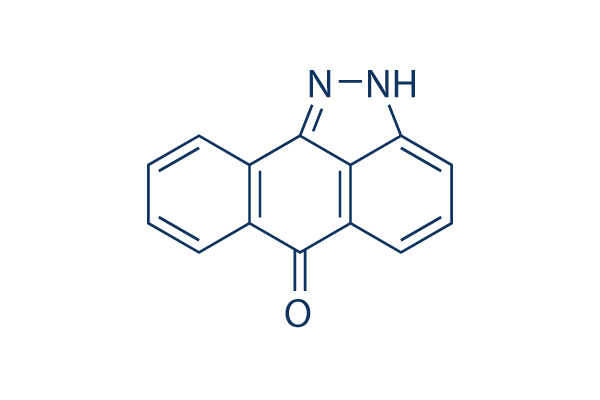
Chemische Struktur
Molekulargewicht: 220.23
Qualitätskontrolle
Produkte, die oft zusammen verwendet werden mit SP600125
| Verwandte Ziele | ERK p38 MAPK Raf MEK Ras KRas S6 Kinase MAP4K TAK1 Mixed Lineage Kinase |
|---|---|
| Weitere JNK Inhibitoren | CC-90001 JNK-IN-8 Anisomycin (Flagecidin) JNK Inhibitor IX Tanzisertib Hydrochloride (CC-930) JNK Inhibitor VIII Polyphyllin I DTP3 BI-78D3 CC-401 Hydrochloride |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| Hep3B | Function Assay | 10 μM | 1 h | Blocks autophagy and upregulation of Beclin 1 expression induced by ceramide | 19060920 | |
| BV-2 | Function Assay | 2 μM | 1 h | Inhibits the increase of sBAFF release in Gmix-treated BV-2 cells | 19406831 | |
| RAW264.7 | Function Assay | 10 μM | 12 h | Antiinflammatory activity assessed as inhibition of LPS-induced NO production with IC50 of 17μM | 19497418 | |
| PC3 | Function Assay | 20 μM | 1 h | Decreases the MMP2 and MMP9 expression | 19633975 | |
| Plasmodium falciparum HB3 | Antibacterial Assay | 72 h | DMSO | Antiplasmodial activity with IC50 of 7.94328 μM | 19734910 | |
| Plasmodium falciparum W2 | Antibacterial Assay | 72 h | DMSO | Antiplasmodial activity with IC50 of 7.94328 μM | 19734910 | |
| Plasmodium falciparum 7G8 | Antibacterial Assay | 72 h | DMSO | Antiplasmodial activity with IC50 of 10 μM | 19734910 | |
| Plasmodium falciparum 3D7 | Antibacterial Assay | 72 h | DMSO | Antiplasmodial activity with IC50 of 12.5893 μM | 19734910 | |
| Plasmodium falciparum GB4 | Antibacterial Assay | 72 h | DMSO | Antiplasmodial activity with IC50 of 12.5893μM | 19734910 | |
| HaCaT | Function Assay | 20 μM | 4 h | DMSO | Blocks the TNF-α-induced CYP4F11 transcription | 19812349 |
| HaCaT | Function Assay | 20 μM | 24 h | DMSO | Blocks the phosphorylation of c-Jun protein | 19812349 |
| A549 | Function Assay | 20 μM | 1 h | Inhibition of TPA-induced MMP-2 and u-PA expression | 20492175 | |
| PC12 | Function Assay | 10 μM | 5 h | DMSO | Activation of Nrf2/ARE assessed as HO-1 protein induction pretreated with PD98059 | 21345685 |
| PC12 | Function Assay | 10 μM | 5 h | DMSO | Activation of Nrf2/ARE assessed as HO-1 protein induction pretreated with U0126 | 21345685 |
| PC12 | Function Assay | 10 μM | 5 h | DMSO | Activation of Nrf2/ARE assessed as HO-1 protein induction pretreated with SP600125 | 21345685 |
| PC12 | Function Assay | 10 μM | 5 h | DMSO | Activation of Nrf2/ARE assessed as HO-1 protein induction pretreated with SB203580 | 21345685 |
| B16-F10 | Function Assay | 1 h | Inhibition of TNF-alpha-induced c-JUN phosphorylation | 21815634 | ||
| LoVo | Function Assay | 1 μM | 1 h | Inhibition of PGE2-induced expression of uPA and MMP-9 significantly | 21859479 | |
| LoVo | Function Assay | 1 μM | 1 h | BlocksPGE2-induced cell migration significantly | 21859479 | |
| THP-1 | Function Assay | 90 nM | 30 min | Inhibition of tissue factor expression | 22940059 | |
| PC3 | Function Assay | 25 μM | 24 h | Inhibition of AP-1 and p21 luciferase activity induced by S179D PRL | 23162652 | |
| SH-SY5Y | Function Assay | 10 μM | 1 h | DMSO | Neuroprotective activity assessed as reduction of anisomycin-induced cell death | 23498914 |
| SH-SY5Y | Kinase Assay | 10 μM | 1 h | DMSO | Inhibition of JNK3 assessed as blockade of anisomycin-induced c-jun phosphorylation at ser73 | 23498914 |
| RAW264.7 | Function Assay | 10 μM | 24 h | Antiinflammatory activity assessed as inhibition of IL-1beta release | 23791078 | |
| RAW264.7 | Function Assay | 10 μM | 24 h | Antiinflammatory activity assessed as inhibition of LPS-induced iNOS expression | 23791078 | |
| RAW264.7 | Function Assay | 10 μM | 2 h | Antiinflammatory activity assessed as inhibition of LPS-induced NO production | 23791078 | |
| A549 | Growth Inhibition Assay | 20 μM | 72 h | DMSO | Rapid and potent inhibition of cell proliferation | 23912840 |
| RAW264.7 | Antiinflammatory assay | Antiinflammatory activity in mouse RAW264.7 cells assessed as inhibition of LPS-induced NO production relative to control, IC50 = 17 μM. | 22831798 | |||
| BMMC | Function assay | 1 to 20 uM | 7 days | Inhibition of RANKL/M-CSF-stimulated osteoclastogenesis in ICR mouse BMMC assessed as reduction in TRAP positive multinucleated cells at 1 to 20 uM incubated for 7 days by light microscopy | 25397676 | |
| A673 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for A673 cells | 29435139 | |||
| BT-37 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-37 cells | 29435139 | |||
| SK-N-SH | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-SH cells | 29435139 | |||
| NB1643 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB1643 cells | 29435139 | |||
| OHS-50 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for OHS-50 cells | 29435139 | |||
| SK-N-MC | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-MC cells | 29435139 | |||
| NB-EBc1 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB-EBc1 cells | 29435139 | |||
| LAN-5 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for LAN-5 cells | 29435139 | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 220.23 | Formel | C14H8N2O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 129-56-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Nsc75890 | Smiles | C1=CC=C2C(=C1)C3=NNC4=CC=CC(=C43)C2=O | ||
Löslichkeit
|
In vitro |
DMSO
: 60 mg/mL
(272.44 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
serine/threonine kinase
JNK1
(Cell-free assay) 40 nM
JNK2
(Cell-free assay) 40 nM
Aurora A
(Cell-free assay) 60 nM
TrkA
(Cell-free assay) 70 nM
JNK3
(Cell-free assay) 90 nM
FLT3
(Cell-free assay) 90 nM
MKK4
(Cell-free assay) 0.4 μM
MKK6
(Cell-free assay) 1.0 μM
PKB
(Cell-free assay) 1.0 μM
MKK3
(Cell-free assay) 1.5 μM
PKCα
(Cell-free assay) 1.5 μM
|
|---|---|
| In vitro |
SP600125 wurde ursprünglich als selektiver ATP-kompetitiver Inhibitor der c-Jun N-terminalen Kinase JNK charakterisiert. In Jurkat-T-Zellen hemmt diese Verbindung die Phosphorylierung von c-Jun mit einer IC50 von 5 μM bis 10 μM. In CD4+-Zellen, wie z.B. Th0-Zellen, die entweder aus menschlichem Nabelschnur- oder peripherem Blut isoliert wurden, blockiert es die Zellaktivierung und -differenzierung und hemmt die Expression entzündlicher Gene COX-2, IL-2, IL-10, IFN-γ und TNF-α, mit einer IC50 von 5 μM bis 12 μM. Spätere Studien zeigen jedoch, dass diese Chemikalie auch den Arylhydrocarbonrezeptor (AhR) , Mps1 und eine Reihe anderer Serine/threonin kinases, einschließlich Aurora kinase A, FLT3, MELK und TRKA , unterdrückt. In Maus-Betazellen MIN6 induziert diese Verbindung (20 μM) die Phosphorylierung von p38 MAPK und dessen nachgeschaltete CREB-abhängige Promotoraktivierung. In HCT116-Zellen blockiert es (20 μM) den Übergang von der G2-Phase zur Mitose und induziert Endoreplikation. Diese Fähigkeit dieses Inhibitors ist unabhängig von der JNK-Inhibition, sondern beruht auf seiner Hemmung der CDK1-Cyclin B-Aktivierung stromaufwärts von Aurora A und Polo-like kinase 1. |
| Kinase-Assay |
In-vitro-Kinase-Assays
|
|
Die Potenz von SP600125 gegenüber Kinasen, einschließlich MPS1, JNK und Aurora kinase A, wird basierend auf der spezifischen Messung des radioaktiven Phosphotransfers auf das Substrat bestimmt. Für jedes Enzym werden zunächst die absoluten Km-Werte für ATP und das spezifische Substrat bestimmt, und jeder Assay wird dann bei optimierten [ATP]- (2·αKm) und [Substrat]- (5·Km) Konzentrationen durchgeführt. Die MPS1-Aktivität wird unter Verwendung von 5 nM MPS1-rekombinantem Protein in 50 mM HEPES pH 7,5, 2,5 mM MgCl2, 1 mM MnCl2, 1 mM DTT, 3 μM NaVO3, 2 mM β-Glycerophosphat, 0,2 mg/mL BSA, 200 μM P38-βtid-Substratpeptid (KRQADEEMTGYVATRWYRAE) und 8 μM ATP mit 1,5 nM 33P-γ-ATP gemessen. Zehn serielle 1:3-Verdünnungen (von 30 μM bis 1,5 nM) dieser Verbindung werden getestet und die IC50 bestimmt.
|
|
| In vivo |
Bei Mäusen hemmt SP600600125 (15 mg/kg oder 30 mg/kg) signifikant die Lipopolysaccharid (LPS)-induzierte TNF-α-Expression und die Anti-CD3-induzierte Apoptose von CD4+ CD8+ Thymozyten. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
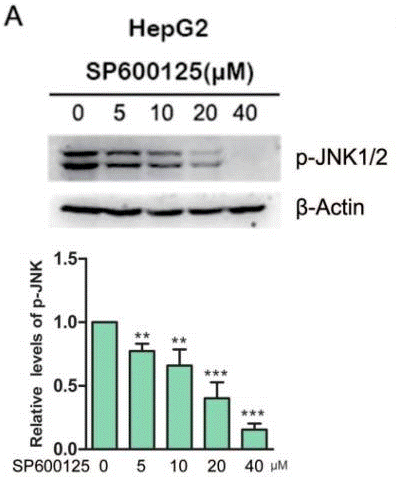
| Western blot | p-JNK p-IGF1R / IGF1R / p-Akt / Akt / p-ERK / ERK p-Src / Src p-c-Jun / c-Jun / pJNK / JNK Survivin / Bcl-2 / PARP p-FADD / FADD / p-c-Jun / c-Jun |
|
25226534 |
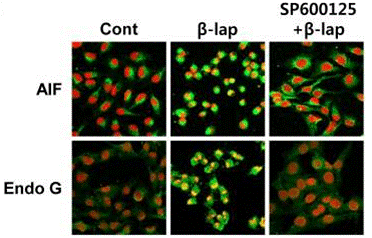
| Immunofluorescence | AIF / Endo G E-cadherin / β-catenin α-catenin / Actin |
|
21738692 |
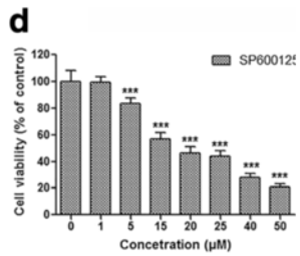
| Growth inhibition assay | Cell viability (U-87 MG) Cell viability (A549) |
|
27176481 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
how to reconstitute the inhibitor for in vivo studies?
Antwort:
It can be dissolved in 5% DMSO/corn oil at 5 mg/ml as a clear solution for injection. For oral administration, this compound dissolved in vehicle 30% PEG400/0.5% Tween80/5%Propylene glycol, at 30mg/ml is a suspension and can be used.
