nur für Forschungszwecke
(R)-(-)-Gossypol (AT-101) acetic acid Bcl-2 Inhibitor
Kat.-Nr.S2812
Chemische Struktur
Molekulargewicht: 578.61
Qualitätskontrolle
| Verwandte Ziele | Caspase PD-1/PD-L1 Ferroptosis p53 Apoptosis related Synthetic Lethality STAT TNF-alpha Ras KRas |
|---|---|
| Weitere Bcl-2 Inhibitoren | Navitoclax (ABT-263) S63845 ABT-737 Obatoclax Mesylate (GX15-070) A-1331852 A-1210477 TW-37 A-1155463 Dihydrochloride AZD5991 UMI-77 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 578.61 | Formel | C30H30O8.C2H4O2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 866541-93-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(172.82 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Mcl-1
(Cell-free assay) 0.18 μM(Ki)
Bcl-2
(Cell-free assay) 0.32 μM(Ki)
Bcl-xL
(Cell-free assay) 0.48 μM(Ki)
|
|---|---|
| In vitro |
AT-101 hemmt eine Reihe verschiedener lymphoproliferativer Malignome mit IC50-Werten von 1,2 μM bis 7,4 μM. AT-101 (10 μM) stört das Δψm in einer konzentrations- und zeitabhängigen Weise in einer diffusen großzelligen B-Zell- und in Mantelzell-Lymphomlinien. AT-101 (1 μM oder 2 μM) in Kombination mit Carfilzomib (6 nM oder 10 nM) induziert Apoptosis in HBL-2- und Granta-Zelllinien. AT-101 (20 μM für 24 Stunden) führt zu einer medianen Apoptosis von 72 % und einer Herunterregulierung von Mcl-1 in CLL-Lymphozyten sowohl in Suspensionskultur als auch in Stromazell-Kokultur. Stromazellen exprimieren nicht nachweisbare Spiegel von Anti-Apoptosis, aber hohe Spiegel von aktivierten ERK- und AKT-Proteinen und zeigen eine geringe oder keine Apoptosis mit AT-101. AT-101 induziert Apoptosis in einer zeit- und dosisabhängigen Weise, mit ED50-Werten von 1,9 mM bzw. 2,4 mM in Jurkat T- und U937-Zellen. AT-101 (10 μM) in Kombination mit Strahlung (32 Gy) induziert mehr Apoptosis als Strahlung allein und übertrifft die Summe der Effekte, die durch die Einzelwirkstoffbehandlungen verursacht werden. AT-101 aktiviert SAPK/JNK in einer dosis- und zeitabhängigen Weise. AT-101 (10 µM) induziert Apoptosis durch Aktivierung von Caspase-9, -3 und -7 in VCaP-Zellen. AT-101 (10 µM) verringert die Bcl-2- und Mcl-1-Expression in VCaP-Zellen. AT-101 (< 20 μM) ist in der Lage, das Wachstum von multiplen Myelomzellen zu hemmen, trotz der stimulierenden Wachstumseffekte, die von Stromazellen im Knochenmarkmilieu bereitgestellt werden. AT-101 (10 μM) induziert Apoptosis in multiplen Myelomzellen über die Aktivierung von Caspasen 3, Caspasen 9 und PARP. AT-101 (10 μM) fördert Apoptosis in multiplen Myelomzellen, indem es das Bax/Bcl-2-Verhältnis und das mitochondriale Membranpotential stört.
|
| Kinase-Assay |
Fluoreszenz-Polarisations-basierter Bindungstest
|
|
Für kompetitive Bindungsexperimente werden Bcl-2-Protein (40 nM) und FAM-Bid-Peptid (2,5 nM) in dem Assaypuffer (100 mM Kaliumphosphat, pH 7,5; 100 μg/mL bovines Gammaglobulin; 0,02 % Natriumazid) vorinkubiert, 5 μL einer Lösung von AT101 in DMSO werden der Bcl-2/FAM-Bid-Lösung in Dynex 96-Well, schwarzen, Rundbodenplatten zugesetzt, um ein Endvolumen von 125 μL zu erhalten. Für jedes Experiment werden eine Kontrolle, die Bcl-2 und Flu-Bid-Peptid (entspricht 0 % Hemmung) enthält, und eine weitere Kontrolle, die nur FAM-Bid enthält, auf jeder Assayplatte eingeschlossen. Nach 4 Stunden Inkubation wurden die Polarisationswerte in Milipolarisationseinheiten (mP) bei einer Anregungswellenlänge von 485 nm und einer Emissionswellenlänge von 530 nm unter Verwendung des Ultra-Plattenlesers gemessen. IC50, die Inhibitorkonzentration, bei der 50 % des gebundenen Peptids verdrängt werden, wird aus der Kurve unter Verwendung einer nichtlinearen Kleinste-Quadrate-Analyse und einer Kurvenanpassung, die mit der GraphPad Prizm 4 Software durchgeführt wurde, bestimmt. Das unmarkierte Bid BH3-Peptid wird als positive Kontrolle verwendet. PF für Bcl-xL-Protein, Bak BH3-Peptid, markiert mit 6-Carboxyfluorescein-Succinimidylester (FAM-Bak) anstelle des FAM-Bim, um das Signal zu maximieren. Es wird festgestellt, dass FAM-Bak eine Kd von 6 nM zu Bcl-xL-Protein hat. Der kompetitive Bindungstest für Bcl-xL ist derselbe wie für Bcl-2 mit folgenden Ausnahmen: 30 nM Bcl-xL-Protein und 2,5 nM FAM-Bak-Peptid im folgenden Assaypuffer: 50 mM Tris-Bis, pH 7,4 und 0,01 % bovines Gammaglobulin. PF für Mcl-1-Protein, FAM-Bid-Peptid und humanes Mcl-1-Protein werden verwendet. Es wird festgestellt, dass FAM-Bid-Peptid mit einer Kd von 1,71 nM an humanes Mcl-1-Protein bindet. Die kompetitiven Bindungstests für Mcl-1 werden auf die gleiche Weise wie die für Bcl-2 durchgeführt, mit folgenden Ausnahmen: 5 nM Mcl-1 und 1 nM Flu-Bid-Peptid im folgenden Assaypuffer: 25 mM Tris, pH 8,0; 150 mM NaCl und 0,05 % Pluronic-Säure
|
|
| In vivo |
AT-101 ist im Plasma mit durchschnittlichen Konzentrationen von 0,49 μM für die 35 mg/kg-Gruppe und 0,39 μM für die 200 mg/kg-Gruppe in SCID-Beige-Mäusen mit RL-DLBCL-Xenograft immer noch nachweisbar. Die maximale Plasmakonzentration von AT-101 wird nach 30 Minuten der Verabreichung des Medikaments bei beiden Dosisstufen beobachtet, wobei die 200 mg/kg-Gruppe eine durchschnittliche Plasmakonzentration aufweist, die fast 4-mal höher ist als die der 35 mg/kg-Gruppe (7,88 μM bzw. 27,78 μM) in SCID-Beige-Mäusen. AT-101 (25 mg/kg bis 100 mg/kg, oral) führt auf unbestimmte Zeit zu einem früheren Beginn des Gewichtsverlusts, der mehr als 10 % des Vorbehandlungsgewichts entspricht, und zum Tod bei SCID-Beige-Mäusen. AT-101 (35 mg/kg, oral pro Tag für 10 Tage) plus intraperitoneales Cyclophosphamid (Cy) und intraperitoneales Rituximab (R) zeigen eine signifikante Tumorkontrolle im Vergleich zu jeder anderen Behandlungsgruppe. AT-101 (15 mg/kg, p.o., 5 Tage/Woche) als Einzelwirkstoff in intakten Mäusen reduziert signifikant die Entwicklung des VCaP-Tumorwachstums im Vergleich zu unbehandelten Tumoren in den Wochen 2 bis 6. AT-101 in Kombination mit chirurgischer Kastration verzögert den Beginn des androgenunabhängigen VCaP-Tumorwachstums im Vergleich zu den Gruppen nur mit Kastration oder nur mit AT-101 bei Mäusen.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Growth inhibition assay | Cell viability |
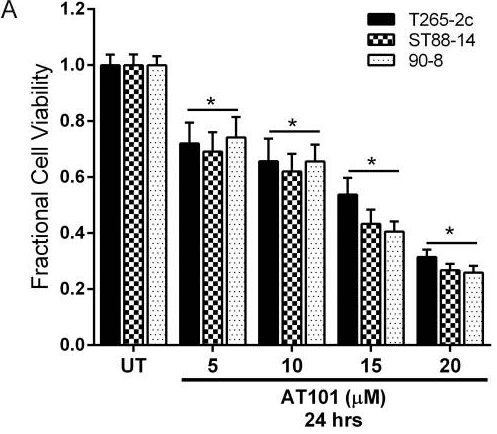
|
24824755 |
| Western blot | BNIP3 Smac / Cyt C p53 / Cox IV p-AKT / AKT APE1 / Bcl-2 / p53 / p-p53 / NF-κB |
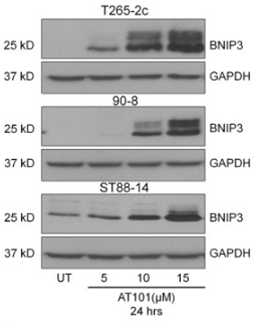
|
24824755 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05338931 | Recruiting | B-cell Non Hodgkin Lymphoma |
AbClon |
March 15 2022 | Phase 1|Phase 2 |
| NCT00934076 | Withdrawn | Carcinoma Non Small Cell Lung |
University of Alabama at Birmingham|Ascenta Therapeutics |
February 2010 | Phase 1 |
| NCT00561197 | Terminated | Locally Advanced Esophageal or GE Junction Cancer |
Ascenta Therapeutics |
August 2007 | Phase 1|Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
Is it S2812 (-)-gossypol or another enantiomer?
Antwort:
It is the R-(–)-gossypol acetic acid.
