nur für Forschungszwecke
Butein EGFR Inhibitor
Kat.-Nr.S8036
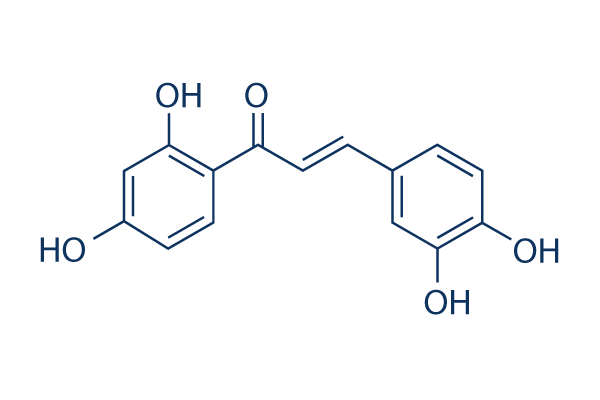
Chemische Struktur
Molekulargewicht: 272.25
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere EGFR Inhibitoren | Lazertinib (YH25448) Icotinib Hydrochloride Sunvozertinib AG-490 AG-1478 Canertinib (CI-1033) WZ4002 Rociletinib (CO-1686) Poziotinib (NOV120101, HM781-36B) Genistein |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 272.25 | Formel | C15H12O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 487-52-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1=CC(=C(C=C1C=CC(=O)C2=C(C=C(C=C2)O)O)O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 55 mg/mL
(202.02 mM)
Ethanol : 55 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
EGFR
|
|---|---|
| In vitro |
Butein hemmt den EGF-stimulierten Auto-Phosphotyrosin-Spiegel des EGF-Rezeptors in HepG2-Zellen und hemmt auch die Tyrosin-spezifische Protein Tyrosine Kinase-Aktivität des EGF-Rezeptors und p60c-src mit einer IC50 von 65 μM in vitro. Die Hemmung ist kompetitiv zu ATP und nicht-kompetitiv zum Phosphatakzeptor, Poly (Glu, Ala, Tyr) 6:3:1 für die EGF-Rezeptor-Tyrosinkinase. Im Gegensatz dazu hemmt diese Verbindung die Aktivitäten von Serin- und Threonin-spezifischen Protein Tyrosine Kinase, wie PKC oder PKA, nicht signifikant. Dieses Chemikalie hemmt Nuclear Factor (NF)-κB und die NF-κB-regulierte Genexpression durch direkte Hemmung der IκBα Kinase β am Cystein 179-Rest. Es (10 μM) hemmt über 90% der iNOS- und COX-2-Expression sowie die Nitrit- und TNF-α-Produktion in LPS-stimulierten RAW 264.7-Zellen. Diese Verbindung (10 μM) hemmt die LPS-induzierte DNA-Bindungsaktivität von NF-κB, die durch Hemmung des Abbaus des inhibitorischen Faktors-κB und der Phosphorylierung der Erk1/2 MAP-Kinase vermittelt wird, sowie erhöht die Bindung des Osteopontin a vb3-Integrinrezeptors. Es (20 μM) induziert morphologische Veränderungen von Blasenkrebszellen BLS(M) von einer elongierten Morphologie zu runden, epithelialähnlichen Zellen, begleitet von einer Herunterregulierung von Vimentin und einer Zunahme von E-Cadherin im Vergleich zu unbehandelten Kontrollzellen, was auf eine Umkehrung des mesenchymähnlichen Phänotyps hindeutet. Diese Chemikalie (20 μM) unterdrückt die Motilität und Invasionskapazität von BLS(M)-Zellen und kehrt den durch TNF-α induzierten EMT-ähnlichen Phänotyp über die ERK1/2- und NF-κB-Signalwege um. Es hemmt die konstitutive Aktivierung von STAT3 in HepG2-Zellen dosisabhängig, wobei die maximale Hemmung bei 50 μM auftritt, vermittelt durch die Hemmung der Aktivierung der vorgeschalteten Kinasen c-Src und Janus-aktivierter Kinase2. Diese Verbindung (50 μM) könnte auch die IL-6-induzierte STAT3-Phosphorylierung in SNU-387-Zellen vollständig hemmen. Es reguliert die Expression von Cyclin D1, Bcl-2, Bcl-xL, Survivin und VEGF, Markern der STAT3-Aktivierung, herunter. Diese Chemikalie (50 μM) verstärkt die apoptotischen Effekte von Doxorubicin signifikant von 18% auf 55% und von Paclitaxel von 15% auf 42%. Es ist ein starkes Antioxidans gegen Lipid- und LDL-Peroxidation. Diese Verbindung hemmt die eiseninduzierte Lipidperoxidation in Rattenhirnhomogenat mit einer IC50 von 3,3 μM. Es ist so potent wie α-Tocopherol bei der Reduktion des stabilen freien Radikals Diphenyl-2-picrylhydrazyl (DPPH) mit einer IC0,2 von 9,2 μM. Diese Chemikalie hemmt auch die Aktivität der Xanthinoxi
dase mit einer IC50 von 5,9 μM. Es fängt das Peroxylradikal ab, das aus 2,2-Azobis(2-amidinopropan)dihydrochlorid (AAPH) in wässriger Phase stammt. Darüber hinaus hemmt diese Verbindung die kupferkatalysierte Oxidation von menschlichem Low-Density-Lipoprotein (LDL) konzentrationsabhängig. Es ist ein Chelatbildner für Eisen- und Kupferionen.
|
| In vivo |
Butein in einer Dosis von 2 mg/kg induziert eine signifikante Hemmung des hepatozellulären Tumorwachstums im Vergleich zu den mit Maisöl behandelten Kontrollen. Bei der Nekropsie am Tag 22 nach der Erstbehandlung zeigte sich eine mehr als 2-fache Abnahme des Tumorwachstums in der mit dieser Verbindung behandelten Gruppe (mittlere relative Tumorlast, 3,90) im Vergleich zur Kontrollgruppe (8,46), verbunden mit reduzierter konstitutiver p-STAT3 (9% vs. 81% der Fahrzeuggruppe), Bcl-2-Spiegel (26% vs. 96% der Fahrzeuggruppe) und erhöhtem Caspase-3-Spiegel (98% vs. 21% der Fahrzeuggruppe) in HCC-Tumorgeweben. Diese Verbindung zeigt antifibrogene Aktivität. Es (25 mg/kg/Tag) reduziert die Serum-AST- und ALT-Aktivierung auf 35 % bzw. 69 % der Kontroll-CCl4-induzierten Rattenwerte. Diese Chemikalie (25 mg/kg/Tag) reduziert den Hydroxyprolin-Gehalt und die TBAR4-Konzentration in der Leber auf 54 % bzw. 54 %. Die Expression von α1(I) Kollagen und TIMP-1 in den mit dieser Verbindung behandelten Ratten beträgt 28 % bzw. 20,3 % im Vergleich zu den Werten für die entsprechenden CCl4-behandelten Kontrollen.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
