nur für Forschungszwecke
PCI 29732 BTK Inhibitor
Kat.-Nr.S6725
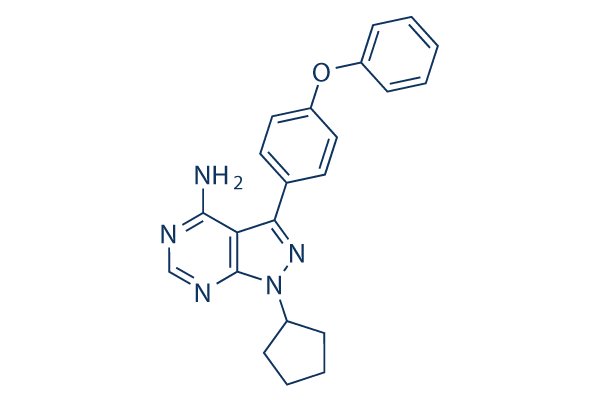
Chemische Struktur
Molekulargewicht: 371.43
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- SDS
- Datenblatt
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 |
|---|---|
| Weitere BTK Inhibitoren | Catadegbrutinib (BGB-16673) Spebrutinib (AVL-292) tirabrutinib(ONO-4059) hydrochloride CGI1746 LFM-A13 CNX-774 Evobrutinib BMS-935177 Fenebrutinib (GDC-0853) Branebrutinib (BMS-986195) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 371.43 | Formel | C22H21N5O |
Lagerung (Ab dem Eingangsdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-Nr. | 330786-25-9 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1CCC(C1)N2C3=NC=NC(=C3C(=N2)C4=CC=C(C=C4)OC5=CC=CC=C5)N | ||
Löslichkeit
|
In vitro |
DMSO
: 74 mg/mL
(199.23 mM)
Ethanol : 4 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
BTK
(Cell-free assay) 0.5 nM
BLK
(Cell-free assay) 0.5 nM
Bmx
(Cell-free assay) 0.8 nM
EGFR
(Cell-free assay) 5.6 nM
YES
(Cell-free assay) 6.5 nM
ErbB2
(Cell-free assay) 9.4 nM
ITK
(Cell-free assay) 10.7 nM
JAK3
(Cell-free assay) 16.1 nM
FRK
(Cell-free assay) 29.2 nM
LCK
(Cell-free assay ) 33.2 nM
RET
(Cell-free assay) 36.5 nM
|
|---|---|
| In vitro |
PCI-32765 blockiert die BCR-Signalübertragung in humanen peripheren B-Zellen in Konzentrationen, die die T-Zell-Rezeptor-Signalübertragung nicht beeinflussen. In DOHH2-Zellen hemmt PCI-32765 die Autophosphorylierung von Btk (IC50, 11 nM), die Phosphorylierung des physiologischen Substrats von Btk, PLCγ (IC50, 29 nM), und die Phosphorylierung einer weiteren nachgeschalteten Kinase, ERK (IC50, 13 nM). PCI-32765 ist mehr als 1.000-fach selektiver für die Hemmung der Antigenrezeptor-Signalübertragung in B-Zellen gegenüber T-Zellen, und dass nur die B-Zell-Hemmung nach kurzzeitiger Behandlung anhält. |
| In vivo |
Bei Mäusen mit Kollagen-induzierter Arthritis reduziert oral verabreichtes PCI-32765 den Spiegel zirkulierender Autoantikörper und unterdrückt die Krankheit vollständig. PCI-32765 hemmt auch die Autoantikörperproduktion und die Entwicklung von Nierenerkrankungen im MRL-Fas(lpr)-Lupusmodell. Die mittlere terminale Plasmahalbwertszeit von PCI-32765 nach oraler Verabreichung bei Mäusen beträgt 1,7 bis 3,1 h. |
Literatur |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
