nur für Forschungszwecke
Procaine HCl Sodium Channel Inhibitor
Kat.-Nr.S4023
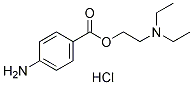
Chemische Struktur
Molekulargewicht: 272.77
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Potassium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Weitere Sodium Channel Inhibitoren | Camostat Mesilate A-803467 cariporide Tolperisone HCl Vinpocetine Veratramine Bulleyaconi cine A Ambroxol HCl Benzocaine Nefopam HCl |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 272.77 | Formel | C13H20N2O2.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 51-05-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Novocaine HCl | Smiles | CCN(CC)CCOC(=O)C1=CC=C(C=C1)N.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 55 mg/mL
(201.63 mM)
Water : 55 mg/mL Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
5-HT3
1.7 μM(Kd)
nAChR
45.5 μM
Sodium channel
60 μM
NMDA receptor
0.296 mM
|
|---|---|
| In vitro |
Procain wirkt hauptsächlich durch die Hemmung des Natriumeinstroms durch spannungsgesteuerte Natriumkanäle in der neuronalen Zellmembran peripherer Nerven. Wenn der Natriumeinstrom unterbrochen wird, kann kein Aktionspotential entstehen und die Signalübertragung wird somit gehemmt. Die Rezeptorstelle befindet sich vermutlich im zytoplasmatischen (inneren) Teil des Natriumkanals. Procain bindet auch an N-Methyl-D-Aspartat (NMDA)-Rezeptoren sowie an nikotinische Acetylcholinrezeptoren und den Serotoninrezeptor-Ionenkanal-Komplex. Procain ist ein Inhibitor der Mechanismen der Ca-induzierten Ca-Freisetzung und der Koffein-induzierten Ca-Freisetzung in verschiedenen Arten von Muskelpräparaten. 0,5 mM Procain blockiert einzelne Ca2+-Freisetzungskanäle des sarkoplasmatischen Retikulums in planaren Lipiddoppelschichten. Procain reduziert weder die Einzelkanalleitfähigkeit noch verkürzt es die mittleren Öffnungszeiten des Kanals merklich, sondern erhöht die längste Geschlossenzeit. Procain ist ein DNA-demethylierendes Mittel mit wachstumshemmenden Effekten in menschlichen Krebszellen. 0,5 mM Procain führt zu einer 40%igen Reduktion der 5-Methylcytosin-DNA in der Brustkrebszelllinie MCF-7. Procain kann auch an CpG-reiche DNA binden und dicht hypermethylierte CpG-Inseln demethylieren, was zur Wiederherstellung der Genexpression epigenetisch silenzierten Gene führt. Procain-Behandlung (0,5 mM) induziert eine Zunahme des Mitoseindex von Zellen in der M-Phase. Procain-Behandlung (1 mM) reduziert die Zellproliferation um ~40%. Procain beeinflusst die Form und Verformbarkeit der roten Blutkörperchen. 45 mM Procain verhindert fast vollständig die mit ATP-Depletion verbundene Discoyten-Echinozyten-Transformation. Ähnliche Konzentrationen von Procain normalisieren die Viskosität und Filtrierbarkeit, haben aber keinen Einfluss auf das Zellvolumen, die osmotische Fragilität oder die monovalente Kationenzusammensetzung von Zellen, die einer ATP-Depletion unterliegen.
|
| In vivo |
Procain ist ein Erreger von Zellen des limbischen Systems. 15 mg/kg Procain erhöht die zelluläreAktivität in Amygdala, ventralem Hippocampus, Nucleus accumbens, temporalem Neokortex und ventromedialem Hypothalamus der wachen Katze. Procain erleichtert die Übertragung evozierter exzitatorischer Aktivität von der Amygdala zum ventromedialen Hypothalamus. Procain beeinflusst Frequenz und Amplitude der retikulär ausgelösten hippokampalen rhythmischen langsamen Aktivität. Procain (0,5 μL, 20% Gew./Vol.), injiziert an Punkten im aufsteigenden System anterior des Supramammillarkerns, in der Region des medialen Vorderhirnbündels oder im medialen Septum, reduziert die Amplitude der retikulär ausgelösten rhythmischen langsamen Aktivität (RSA), hat aber keinen Effekt auf deren Frequenz. Procain, injiziert an Punkten im aufsteigenden System von unmittelbar anterior der Stimulationsstelle der Formatio reticularis bis hin zum Supramammillarkern, reduziert sowohl die Frequenz als auch die Amplitude der retikulär ausgelösten RSA. Procain (80 mg/kg) erhöht die Dauer und Ausbreitung von epileptiformen Nachschlägen (ADs), die durch elektrische Stimulation der Amygdala bei Ratten erzeugt werden. Procain erhöht auch die Rate der Anfallsentwicklung (Kindling), die durch wiederholte Stimulation der Amygdala erzeugt wird. Procain würde selbst als Konvulsivum bei gut gekindelten Probanden wirken. Procain erzeugt eine schwache, aber signifikante Zunahme der Amplitude des transkallosalen evozierten Potentials. Procain beeinflusst die Generierung auditorischer Hirnstammpotentiale (ABRs). Procain (30 μL einer 1%igen Lösung), injiziert in den Trapezkörper des Meerschweinchens, beeinflusst viele Komponenten des von der Kopfhaut abgeleiteten ABR: N2 wird verzögert, wodurch P2 in der Dauer breiter wird, P3 und N3 gehen verloren, P4 wird in der Latenz verkürzt, in der Dauer verbreitert, aber in der Amplitude unbeeinflusst, und N4 wird erheblich abgeschwächt. Nur P1 und N1 bleiben von der Procain-Injektion unbeeinflusst. Procain erhöht den therapeutischen Index von Cisplatin, indem es die Antitumoraktivität von Cisplatin verbessert und dessen Nephrotoxizität reduziert. Die gleichzeitige Verabreichung von Cisplatin und Procain (40 mg/kg) an BDF1-Mäuse führt zu Letaldosis-Werten von 50% (LD50) und 90% (LD90), die etwa doppelt so hoch sind wie die, die mit Cisplatin allein beobachtet wurden. Die gleichzeitige Verabreichung führt zu höheren Heilungsraten im Vergleich zu Cisplatin allein (50% vs. 9%). Die erhöhten Blut-Harnstoff-Stickstoff (BUN)-Werte, die 4-7 Tage nach einer einzelnen Cisplatin-Verabreichung beobachtet wurden, sowie die tubulären degenerativen Veränderungen, die mittels Lichtmikroskopie festgestellt wurden, werden nicht beobachtet, wenn die gleichen Cisplatin-Dosen gleichzeitig mit Procain verabreicht werden.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03805503 | Completed | Spinal Anesthesia |
University Hospital Ghent |
September 16 2015 | Phase 4 |
| NCT02287870 | Completed | Anesthesia |
Jinling Hospital China |
January 2008 | Phase 4 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
