nur für Forschungszwecke
Sonidegib (NVP-LDE225, Erismodegib) Smo Antagonist
Kat.-Nr.S2151
Chemische Struktur
Molekulargewicht: 485.5
Qualitätskontrolle
| Verwandte Ziele | JAK TGF-beta/Smad Wnt/beta-catenin ERK GSK-3 ROCK PKA Secretase STAT Casein Kinase |
|---|---|
| Weitere Hedgehog/Smoothened Inhibitoren | SAG (Smoothened Agonist) Hydrochloride Purmorphamine Cyclopamine (11-Deoxojervine) GANT61 SAG (Smoothened Agonist) SANT-1 HPI-4 (Ciliobrevin A) BMS-833923 Taladegib (LY2940680) Ciliobrevin D |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| A2780ip2 | Cytoxicity assay | ~10 μM | IC50=12 μM | 22553355 | ||
| A2780cp20 | Cytoxicity assay | ~10 μM | IC50=7.5 μM | 22553355 | ||
| SKOV3ip1 | Cytoxicity assay | ~10 μM | IC50=24 μM | 22553355 | ||
| SKOV3TRip2 | Cytoxicity assay | ~10 μM | IC50=12 μM | 22553355 | ||
| HeyA8 | Cytoxicity assay | ~10 μM | IC50=18 μM | 22553355 | ||
| HeyA8MDR | Cytoxicity assay | ~10 μM | IC50=8 μM | 22553355 | ||
| OS5 | Growth inhibitory assay | ~5 μM | reduces the proliferation | 23243595 | ||
| OS18 | Growth inhibitory assay | ~5 μM | reduces the proliferation | 23243595 | ||
| Glioblastoma initiating cells | Cytoxicity assay | ~10 μM | Inhibits Cell Viability | 23482671 | ||
| Glioblastoma initiating cells | Function assay | ~10 μM | inhibits neurosphere formation | 23482671 | ||
| Glioblastoma initiating cells | Cytoxicity assay | ~10 μM | induces apoptosis | 23482671 | ||
| Glioblastoma initiating cells | Function assay | ~10 μM | downregulates the SHH signaling pathway | 23482671 | ||
| Glioblastoma initiating cells | Function assay | ~10 μM | Inhibits the Expression of Genes Involved in Maintaining Pluripotency | 23482671 | ||
| Glioblastoma initiating cells | Function assay | ~10 μM | Inhibits Motility, Invasion, and Migration | 23482671 | ||
| LOX IMVI | Function assay | 10 μM | DMSO | inhibits Hedgehog-GLI pathway | 23935925 | |
| UACC 257 | Function assay | 10 μM | DMSO | inhibits Hedgehog-GLI pathway | 23935925 | |
| LOX IMVI | Function assay | 10 μM | DMSO | induces G1 cell cycle arrest | 23935925 | |
| UACC 257 | Function assay | 10 μM | DMSO | induces G1 cell cycle arrest | 23935925 | |
| LOX IMVI | Cytoxicity assay | 10 μM | DMSO | decreases tumor cell viability | 23935925 | |
| UACC 257 | Cytoxicity assay | 10 μM | DMSO | decreases tumor cell viability | 23935925 | |
| LOX IMVI | Apoptosis assay | 10 μM | DMSO | induces apoptosis | 23935925 | |
| UACC 257 | Apoptosis assay | 10 μM | DMSO | induces apoptosis | 23935925 | |
| ACHN | Growth inhibitory assay | ~5 μM | DMSO | IC50=2-3 μM | 25093491 | |
| 769-P | Growth inhibitory assay | ~5 μM | DMSO | IC50=2-3 μM | 25093491 | |
| 786-O | Growth inhibitory assay | ~5 μM | DMSO | IC50=2-3 μM | 25093491 | |
| 786-O SuR | Growth inhibitory assay | ~5 μM | DMSO | IC50=2-3 μM | 25093491 | |
| SP53 | Function assay | 30 μM | DMSO | inhibits cell adhesion and migration | 26885608 | |
| SP53 | Function assay | 30 μM | DMSO | inhibits the VLA4-mediated FAK signaling pathway | 26885608 | |
| HS5 | Function assay | 30 μM | DMSO | inhibits cell adhesion and migration | 26885608 | |
| HS27a | Function assay | 30 μM | DMSO | inhibits cell adhesion and migration | 26885608 | |
| SP53 | Cytoxicity assay | 30 μM | DMSO | induces autophagy | 26885608 | |
| Jeko | Cytoxicity assay | 30 μM | DMSO | induces autophagy | 26885608 | |
| U2OS | Function assay | 2 hrs | Displacement of [3H]cyclopamine from wild type Smo expressed in U2OS cells after 2 hrs by scintillation counting, Ki = 0.006 μM. | 23063522 | ||
| NIH/3T3 | Function assay | Inhibition of hedgehog signaling pathway in mouse NIH/3T3 cells expressing wild type Smo assessed as reduction in Gli mRNA expression by RT-PCR method, IC50 = 0.0044 μM. | 27810591 | |||
| NIH/3T3 | Function assay | Inhibition of hedgehog signaling pathway in mouse NIH/3T3 cells harboring Smo D477H mutant assessed as reduction in Gli mRNA expression by RT-PCR method, IC50 = 0.0227 μM. | 27810591 | |||
| NIH/3T3 | Function assay | 24 hrs | Inhibition of hedgehog signaling pathway in mouse NIH/3T3 cells measured after 24 hrs by Gli-dual luciferase reporter gene assay, IC50 = 0.006 μM. | 27810591 | ||
| TM3 | Function assay | 48 hrs | Inhibition of Hh signaling pathway in mouse TM3 cells assessed as downregulation of Gli1 gene expression after 48 hrs by luciferase reporter gene assay, EC50 = 0.0012 μM. | 26976215 | ||
| NIH3T3 | Function assay | 48 hrs | Inhibition of SHH signaling pathway in mouse NIH3T3 cells measured after 48 hrs by Gli-luciferase reporter assay, IC50 = 0.0055 μM. | 24176396 | ||
| NIH3T3 | Function assay | 48 hrs | Inhibition of Sonic-induced hedgehog signalling in mouse NIH3T3 cells after 48 hrs by Gli-luciferase reporter assay, IC50 = 0.0055 μM. | 26820554 | ||
| NIH/3T3 | Function assay | Inhibition of hedgehog signaling pathway expressed in mouse NIH/3T3 cells assessed as inhibition of hedgehog-induced Gli-2 accumulation at tip of primary cilia by DAPI staining based confocal microscopic analysis | 27810591 | |||
| NIH/3T3 | Function assay | Inhibition of hedgehog signaling pathway in mouse NIH/3T3 cells assessed as inhibition of hedgehog-induced Smo-EGFP ciliary translocation by DAPI staining based confocal microscopic analysis | 27810591 | |||
| MG 63 (6-TG R) | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Confirmatory screen for MG 63 (6-TG R) cells | 29435139 | |||
| Rh41 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Confirmatory screen for Rh41 cells | 29435139 | |||
| U-2 OS | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Confirmatory screen for U-2 OS cells | 29435139 | |||
| A673 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for A673 cells | 29435139 | |||
| BT-12 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-12 cells | 29435139 | |||
| MG 63 (6-TG R) | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for MG 63 (6-TG R) cells | 29435139 | |||
| NB-EBc1 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB-EBc1 cells | 29435139 | |||
| OHS-50 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for OHS-50 cells | 29435139 | |||
| Saos-2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Saos-2 cells | 29435139 | |||
| SJ-GBM2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SJ-GBM2 cells | 29435139 | |||
| SK-N-MC | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-MC cells | 29435139 | |||
| SK-N-SH | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-SH cells | 29435139 | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 485.5 | Formel | C26H26F3N3O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 956697-53-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NVP-LDE225, Erismodegib | Smiles | CC1CN(CC(O1)C)C2=NC=C(C=C2)NC(=O)C3=CC=CC(=C3C)C4=CC=C(C=C4)OC(F)(F)F | ||
Löslichkeit
|
In vitro |
DMSO
: 97 mg/mL
(199.79 mM)
Ethanol : 16 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Smo (mouse)
(Cell-free assay) 1.3 nM
Smo (human)
(Cell-free assay) 2.5 nM
|
|---|---|
| In vitro |
Sonidegib (Erismodegib, NVP-LDE225) hemmt die luciferierte TM3-Zelllinie mit 0,6 nM und 8 nM in Anwesenheit von 1 nM bzw. 25 nM Hh-Agonist Ag1.5.
|
| In vivo |
Sonidegib (Erismodegib, NVP-LDE225) ist stark an Maus-, Ratten- und Humanplasmaproteine (>99%) gebunden und mäßig an Hunde- und Affenplasmaproteine (77% bzw. 85%) gebunden. LDE225 weist im PAMPA-Assay eine hohe Permeabilität auf (90,8% beim Menschen). LDE225 zeigt in präklinischen Spezies eine gute orale Bioverfügbarkeit von 69 bis 102%, wenn es in Lösung dosiert wird. LDE225 ist eine schwache Base mit einem gemessenen pKa von 4,20 und weist eine relativ schlechte wässrige Löslichkeit auf. LDE225 zeigt eine dosisabhängige Antitumoraktivität. Bei einer Dosis von 5 mg/kg/Tag qd hemmt LDE225 das Tumorwachstum signifikant, was einem T/C-Wert von 33% entspricht. Bei einer Dosierung von 10 und 20 mg/kg/Tag qd führt LDE225 zu einer Regression von 51% bzw. 83%. Die Gli1-mRNA-Hemmung korreliert mit der Tumor- und Plasmaexposition von LDE225. LDE225 durchdringt die Blut-Hirn-Schranke bei tumortragenden Tieren erfolgreich und führt nach 4 Behandlungstagen zu einer Hemmung des Tumorwachstums. LDE225 reduziert das Tumorvolumen bei Rip1-Tag2-Mäusen um 95,7%. LDE225 verlängert das Überleben bei Rip1Tag2-Mäusen. LDE225 verringert die Expression von Stromamarkern bei den mit LDE225 behandelten Mäusen.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
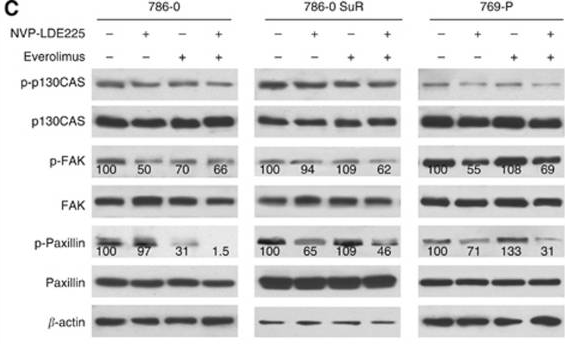
| Western blot | p-p130CAS / p130CAS / p-FAK / FAK / p-Paxillin / Paxillin pp70S6K / P70s6k Gli-1 / Gli-2 / p-Akt / Akt Bcl2 / c-myc / Cyclin D1 / pERK / ERK / pJNK / JNK / Caspase 3 / Cleaved caspase 3 |
|
25093491 |
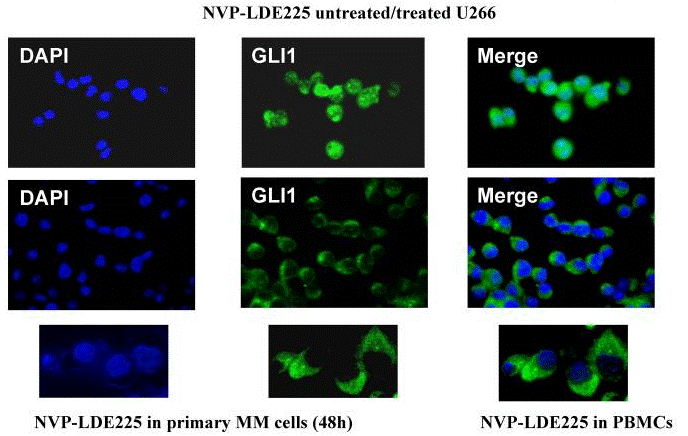
| Immunofluorescence | GLI1 |
|
22821765 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02358161 | Completed | Pancreatic Cancer |
Academisch Medisch Centrum - Universiteit van Amsterdam (AMC-UvA)|Novartis|Celgene Corporation |
September 2015 | Phase 1|Phase 2 |
| NCT02254551 | Terminated | Multiple Myeloma |
SCRI Development Innovations LLC|Novartis |
January 2015 | Phase 2 |
| NCT02138929 | Completed | Esophageal Cancer |
M.D. Anderson Cancer Center|Novartis|National Cancer Institute (NCI) |
November 10 2014 | Phase 1 |
| NCT02195973 | Completed | Recurrent Ovarian Cancer |
University of Alabama at Birmingham|Novartis Pharmaceuticals |
September 2014 | Phase 1 |
| NCT02027376 | Completed | Advanced Breast Cancer |
Spanish Breast Cancer Research Group|Novartis |
May 2014 | Phase 1 |
| NCT02111187 | Completed | Prostate Cancer |
Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins |
April 2014 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
