nur für Forschungszwecke
TIC10 (ONC201) Akt Inhibitor
Kat.-Nr.S7963
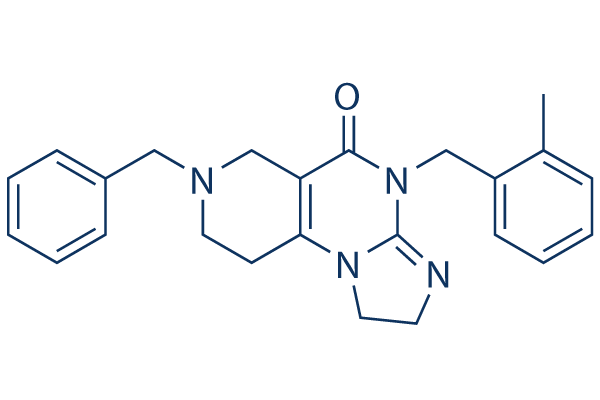
Chemische Struktur
Molekulargewicht: 386.49
Qualitätskontrolle
| Verwandte Ziele | PI3K mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere Akt Inhibitoren | SC79 AZD5363 (Capivasertib) MK-2206 Dihydrochloride Ipatasertib (GDC-0068) Perifosine GSK690693 Triciribine (API-2) Afuresertib (GSK2110183) CCT128930 A-674563 HCl |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 386.49 | Formel | C24H26N4O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1616632-77-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=CC=CC=C1CN2C(=O)C3=C(CCN(C3)CC4=CC=CC=C4)N5C2=NCC5 | ||
Löslichkeit
|
In vitro |
DMSO
: 77 mg/mL
(199.22 mM)
Ethanol : 77 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Akt
ERK
|
|---|---|
| In vitro |
In p53-unabhängiger Weise bewirkt TIC10 (ONC201) eine dosisabhängige Zunahme der TRAIL-mRNA und induziert die Lokalisierung von TRAIL-Protein auf der Zelloberfläche mehrerer Krebszelllinien. Es hat eine breite Aktivität gegen multiple Malignome in vitro und induziert eine Zunahme des sub-G1-DNA-Gehalts, was auf Zelltod in TRAIL-sensitiven HCT116 p53−/−-Zellen hindeutet, verändert aber nicht die Zellzyklusprofile normaler Fibroblasten bei äquivalenten Dosen. Diese Verbindung verringert das klonogene Überleben von Krebszelllinien und schont normale Fibroblasten. Sie erhöht den Prozentsatz der sub-G1-DNA in Krebszellen in p53-unabhängiger und Bax-abhängiger Weise, wie zuvor für TRAIL-vermittelte Apoptose berichtet. Die TIC10-induzierte TRAIL-Hochregulierung ist Foxo3a-abhängig, was auch den TRAIL-Todesrezeptor DR5 unter anderen Zielen hochreguliert und möglicherweise eine Sensibilisierung einiger TRAIL-resistenter Tumorzellen ermöglicht. Der Wirkstoff inaktiviert die Kinasen Akt und extrazellulär signalregulierte Kinase (ERK), was zur Translokation von Foxo3a in den Zellkern führt, wo es an den TRAIL-Promotor bindet, um die Gentranskription hochzuregulieren. Es ist ein wirksames Antitumor-Therapeutikum, das auf Tumorzellen und deren Mikroumgebung einwirkt, um die Konzentrationen des endogenen Tumorsuppressors TRAIL zu erhöhen. |
| In vivo |
Im HCT116 p53−/− Xenotransplantat führt die Behandlung mit TIC10 (ONC201) und TRAIL zu einer vergleichbaren Tumorregression, wenn beide in mehreren Dosen verabreicht werden. Es induziert auch die Regression von MDA-MB-231 humanen dreifach-negativen Brustkrebs-Xenotransplantaten, während TRAIL-behandelte Tumoren progredient waren. Bei DLD-1 Kolonkarzinom-Xenotransplantaten induziert diese Verbindung 1 Woche nach der Behandlung eine Tumorstasis, während TRAIL-behandelte Tumoren nach einer Einzeldosis progredient sind. Eine Einzeldosis davon induziert auch eine anhaltende Regression des SW480 Xenotransplantats und ist gleichermaßen wirksam, wenn sie intraperitoneal oder oral verabreicht wird, was auf eine günstige orale Bioverfügbarkeit hindeutet. Es verursacht einen tumorspezifischen Zelltod durch TRAIL-vermittelte direkte und Bystander-Effekte und ist ein wirksames Antitumormittel gegen orthotope menschliche Glioblastoma-multiforme-Tumoren. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
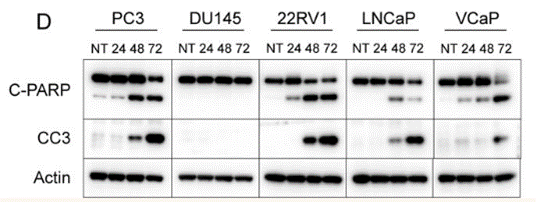
| Western blot | Cleaved PARP / CC3 ATF4 / ATF3 p-GCN2 / GCN2 / p-eIF2a / eIF2a p-p70S6K / p-S6 / p-4EBP1 / 4EBP1 / p-HSF1 / HSF1 |
|
29588331 |
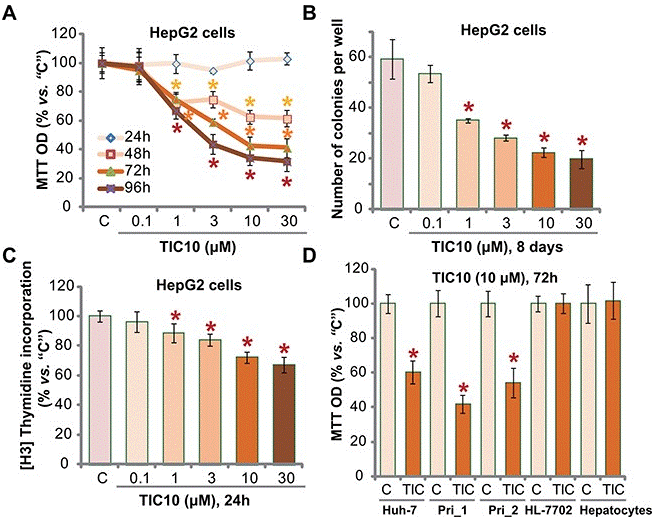
| Growth inhibition assay | Cell viability |
|
29588330 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT04629209 | Withdrawn | Glioblastoma |
Masonic Cancer Center University of Minnesota|University of Minnesota |
June 28 2024 | Phase 2 |
| NCT06012929 | Not yet recruiting | Meningioma|Refractory Meningioma|Relapsed Meningioma |
University of Nebraska|Chimerix |
April 2024 | Phase 1 |
| NCT05476939 | Recruiting | Diffuse Intrinsic Pontine Glioma|Diffuse Midline Glioma H3 K27M-Mutant |
Gustave Roussy Cancer Campus Grand Paris|Chimerix|Innovative Therapies For Children with Cancer Consortium |
September 29 2022 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
