nur für Forschungszwecke
Allopurinol ROS Inhibitor
Kat.-Nr.S1630
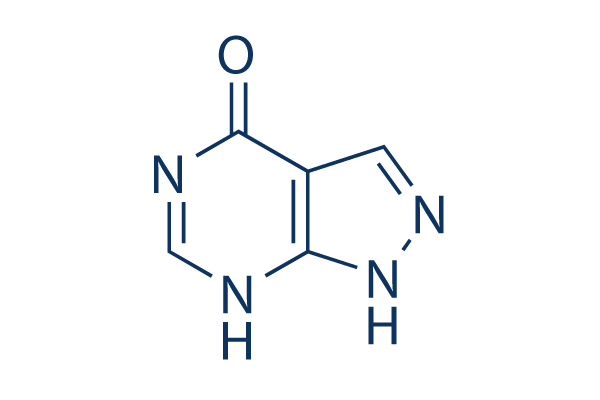
Chemische Struktur
Molekulargewicht: 136.11
Qualitätskontrolle
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 136.11 | Formel | C5H4N4O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 315-30-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1=NNC2=C1C(=O)NC=N2 | ||
Löslichkeit
|
In vitro |
DMSO
: 27 mg/mL
(198.36 mM)
Ethanol : 3 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
xanthine oxidase
|
|---|---|
| In vitro |
Allopurinol kehrt die erhöhte Xanthinoxidase-Aktivität bei Ischämie-Reperfusionsschäden von neonatalen Rattenherzen um. Diese Verbindung (10 mM) unterdrückt die durch Hypoxie-Reoxygenierungs-Schäden induzierte Xanthinoxidase-Aktivität und die Produktion von reactive oxygen species. Sie verringert auch die Konzentration von intrazellulärem Ca2+, das durch eine erhöhte Xanthinoxidase-Aktivität ansteigt.
|
| In vivo |
Allopurinol zeigt eine abnormale Pyrimidinstoffwechselstörung zusammen mit Nierentoxizität, die durch Uridin verbessert werden könnte, was darauf hindeutet, dass diese Verbindung im Wesentlichen eine Pyrimidinstoffwechselstörung verursacht, die zu Nierenfunktionsstörungen bei normalen Mäusen führt. Es erhöht die Harn-OD-Ausscheidung in einem ähnlichen Ausmaß wie bei normalen Mäusen, denen die gleiche Dosis dieser Chemikalie in DNFB-sensibilisierten Mäusen verabreicht wurde. Diese Verbindung fördert eine klinische Verbesserung, die mit einer Reduzierung der parasitären Belastung im Blut, in der Haut und in den Lymphknoten einhergeht, aber selbst nach langer Allopurinol-Verabreichung allein kann Leishmania bei Leishmania-infizierten Hunden in den Hundegeweben persistieren. Es verhindert frühe alkoholbedingte Leberschäden bei Ratten, höchstwahrscheinlich durch die Verhinderung der oxidationsabhängigen Aktivierung von NF-kappaB. Diese Chemikalie schützt dosisabhängig vor Paracetamol-induzierter Zellschädigung, dem ATP-Verlust und dem Anstieg des GSSG-Gehalts in der gesamten Leber und im mitochondrialen Kompartiment, ohne die Bildung reaktiver Metaboliten bei Mäusen zu hemmen. Es hemmt fast vollständig die hepatische Xanthinoxidase- und Dehydrogenase-Aktivität, aber nur hohe Dosen verhindern den Anstieg des mitochondrialen GSSG-Gehalts.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05665699 | Recruiting | Gout |
InventisBio Co. Ltd |
April 17 2023 | Phase 2 |
| NCT05193838 | Unknown status | Dilated Cardiomyopathy |
Assiut University |
May 1 2022 | -- |
| NCT05360628 | Completed | Healthy |
InventisBio Co. Ltd |
November 1 2021 | Early Phase 1 |
| NCT04853615 | Not yet recruiting | SGLT2i Kideny Protection Against Contrast in Diabetic Kidney |
Fayoum University|Cairo University |
July 1 2021 | -- |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
