nur für Forschungszwecke
DesMethyl Erlotinib (OSI-420) HCl EGFR Inhibitor
Kat.-Nr.S2205
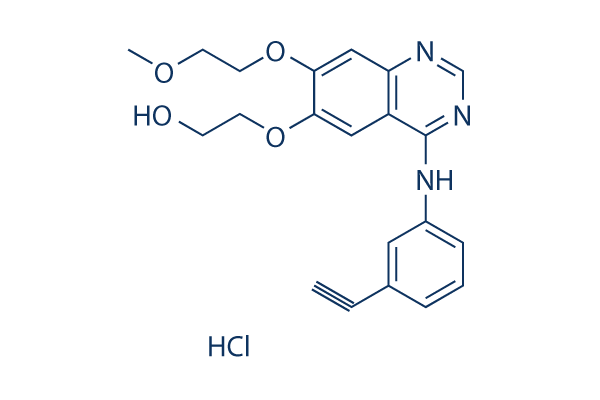
Chemische Struktur
Molekulargewicht: 415.87
Qualitätskontrolle
| Verwandte Ziele | VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere EGFR Inhibitoren | Lazertinib (YH25448) Icotinib Hydrochloride Sunvozertinib AG-490 AG-1478 Canertinib (CI-1033) WZ4002 Rociletinib (CO-1686) Poziotinib (NOV120101, HM781-36B) Genistein |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 415.87 | Formel | C21H21N3O4.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 183320-51-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | CP-473420 | Smiles | COCCOC1=C(C=C2C(=C1)N=CN=C2NC3=CC=CC(=C3)C#C)OCCO.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 83 mg/mL
(199.58 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
OSI 420 is a major active metabolite of Erlotinib.
|
|---|---|
| Targets/IC50/Ki |
EGFR
2 nM
|
| In vitro |
OSI-420 ist der Hauptmetabolit von Erlotinib im menschlichen Plasma. Das Verschwinden von Erlotinib aus dem Plasma nach einer kurzen IV-Infusion ist biexponentiell mit einer mittleren terminalen Halbwertszeit von 5,2 h und einer mittleren Clearance von 128 ml/min pro m(2). Die OSI-420-Exposition (AUC) im Plasma beträgt 30 % (Bereich 12-59 %) von Erlotinib, und die OSI-420-Clearance ist mehr als 5-mal höher als die von Erlotinib. Erlotinib und OSI-420 sind gleich potent, und die kombinierten Konzentrationen von Erlotinib + OSI-420, die im Liquor erreicht wurden, überschritten die IC50 (7,9 ng/ml oder 20 nM) für die EGFR-Tyrosinkinase-Hemmung in intakten Tumorzellen. Erlotinib hemmt potent die EGFR-Aktivierung in intakten Zellen, einschließlich menschlicher HNS-Kopf- und Hals-Tumorzellen (IC50 20nM), DiFi-Darmkrebszellen und MDA MB-468-Brustkrebszellen. Erlotinib (1 μM) induziert Apoptose in menschlichen DiFi-Darmkrebszellen. Erlotinib hemmt das Wachstum einer Reihe von NSCLC-Zelllinien, einschließlich A549, H322, H3255, H358 H661, H1650, H1975, H1299, H596 mit IC50-Werten von 29 nM bis >20 μM. Erlotinib (2 μM) hemmt signifikant das Wachstum von AsPC-1- und BxPC-3-Pankreaszellen. Die Wirkungen von Erlotinib HCl in Kombination mit Gemcitabin werden bei KRAS-mutierten Pankreaskrebszellen als additiv angesehen. Zehn Mikromolar Erlotinib hemmt die EGFR-Phosphorylierung an den Y845 (Src-abhängige Phosphorylierung) und Y1068 (Auto-Phosphorylierung) Stellen. Die Kombination mit Erlotinib könnte die Rapamycin-stimulierte Akt-Aktivität herabregulieren und einen synergistischen Effekt auf die Zellwachstumshemmung erzeugen.
|
| Kinase-Assay |
Kinase-Assays
|
|
96-Well-Platten werden über Nacht bei 37 °C mit 100 μL pro Well von 0,25 mg/mL PGT in PBS beschichtet. Überschüssiges PGT wird durch Absaugen entfernt und die Platte 3-mal mit Waschpuffer (0,1% Tween 20 in PBS) gewaschen. Die Kinase-Reaktion wird in 50 μL von 50 mM HEPES (pH 7,3) durchgeführt, das 125 mM Natriumchlorid, 24 mM Magnesiumchlorid, 0,1 mM Natriumorthovanadat, 20 μM ATP, 1,6 μg/mL EGF und 15 ng EGFR enthält, affinitätsgereinigt aus A431-Zellmembranen. Erlotinib HCl in DMSO wird zugegeben, um eine finale DMSO-Konzentration von 2,5% zu ergeben. Die Phosphorylierung wird durch Zugabe von ATP initiiert und erfolgte 8 Minuten bei Raumtemperatur unter ständigem Schütteln. Die Kinase-Reaktion wird durch Absaugen der Reaktionsmischung beendet und 4-mal mit Waschpuffer gewaschen. Phosphoryliertes PGT wird durch 25-minütige Inkubation mit 50 μL pro Well HRP-konjugiertem PY54 Anti-Phosphotyrosin-Antikörper gemessen, verdünnt auf 0,2 μg/mL in Blockierpuffer (3% BSA und 0,05% Tween 20 in PBS). Der Antikörper wird durch Absaugen entfernt und die Platte 4-mal mit Waschpuffer gewaschen. Das kolorimetrische Signal wird durch Zugabe von TMB Microwell Peroxidase Substrate, 50μL pro Well, entwickelt und durch Zugabe von 0,09 M Schwefelsäure, 50 μL pro Well, gestoppt. Phosphotyrosin wird durch Messung der Absorption bei 450 nm geschätzt. Das Signal für Kontrollen beträgt typischerweise 0,6-1,2 Absorptionseinheiten, mit praktisch keinem Hintergrund in Wells ohne AlP, EGFR oder PGT und ist proportional zur Inkubationszeit von 10 Minuten.
|
|
| In vivo |
Bei Dosen von 100 mg/kg verhindert Erlotinib vollständig die EGF-induzierte Autophosphorylierung von EGFR in menschlichen HN5-Tumoren, die als Xenografts in athymischen Mäusen wachsen, und des hepatischen EGFR der behandelten Mäuse. Erlotinib reduziert das Wachstum von xenotransplantierten menschlichen AML-Zellen.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00124657 | Completed | Brain and Central Nervous System Tumors |
St. Jude Children''s Research Hospital|Rady Children''s Hospital San Diego|Duke University |
March 2005 | Phase 1|Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
