nur für Forschungszwecke
Delanzomib Proteasome Inhibitor
Kat.-Nr.S1157
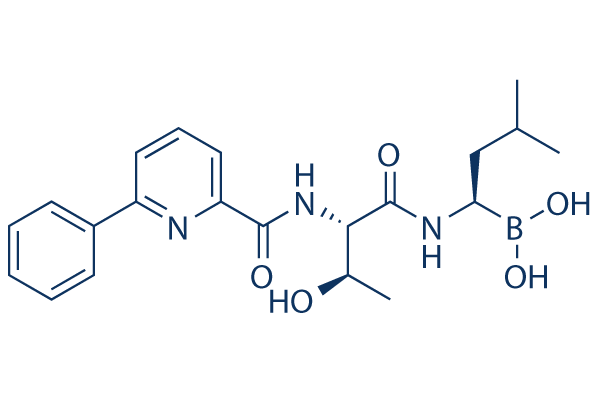
Chemische Struktur
Molekulargewicht: 413.28
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | HDAC Caspase Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease Serine Protease |
|---|---|
| Weitere Proteasome Inhibitoren | MG132 Celastrol Epoxomicin (BU-4061T) ONX-0914 (PR-957) Oprozomib VR23 Marizomib (Salinosporamide A) PI-1840 KSQ-4279 (USP1-IN-1) Isoginkgetin |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 413.28 | Formel | C21H28BN3O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 847499-27-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | CEP-18770 | Smiles | B(C(CC(C)C)NC(=O)C(C(C)O)NC(=O)C1=CC=CC(=N1)C2=CC=CC=C2)(O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 83 mg/mL
(200.83 mM)
Ethanol : 83 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Chymotrypsin-like proteasome
3.8 nM
|
|---|---|
| In vitro |
CEP-18770 zeigt eine geringfügige Prävention der tryptischen und peptidyl-glutamylen Aktivitäten des Proteasome. CEP-18770 hemmt A2780-Ovarialkarzinomzellen, PC3-Prostatakrebs, H460, LoVo-Darmkrebs, RPMI8226-multiples Myelom und HS-Sultan-anaplastisches Non-Hodgkin-Lymphom mit IC50-Werten von 13,7, 22,2, 34,2, 11,3, 5,6 und 8,2 nM. CEP-18770 blockiert den Ubiquitin-Proteasome-Weg in mehreren MM und in der chronisch myeloischen Leukämiezelllinie K562. CEP-18770 führt zu einer Akkumulation von ubiquitinierten Proteinen über 4 bis 8 Stunden. Die IκBα-Degradation wird durch Vorbehandlung mit CEP-18770 vollständig blockiert. CEP-18770 hemmt signifikant hohe NF-κB-Aktivitätswerte sowohl in RPMI-8226- als auch in U266-Zellen. Die zeit- und konzentrationsabhängige Suppression der NF-kB-DNA-Bindungsaktivität in MM-Zelllinien durch CEP-18770 führt zu einer Abnahme der Expression mehrerer NF-κB-modulierter Gene, die das Wachstum und Überleben von Tumorzellen vermitteln, einschließlich IkBα selbst, des X-chromosomal-gebundenen Inhibitor-of-Apoptosis-Proteins (XIAP), der proinflammatorischen Zytokine TNF-α und Interleukin-1β (IL-1β), des intrazellulären Adhäsionsmoleküls (ICAM1) und des pro-angiogenen Faktors vaskulärer endothelialer Wachstumsfaktor. Die Expression dieser NF-κB-vermittelten Gene ist mit einer günstigeren klinischen Reaktion auf dieses Mittel verbunden, was ihren potenziellen prognostischen Wert bei der Reaktion auf CEP-18770-Exposition unterstreicht. Die proapoptotische Aktivität von CEP-18770 gegen MM ist nicht allein auf Tumorzelllinien des MM beschränkt, sondern erstreckt sich auch auf primäre MM-Explante von Patienten mit Rezidiven oder refraktären Erkrankungen. Darüber hinaus führt CEP-18770 in Kombination zu einer synergistischen Hemmung der MM-Zellviabilität in vitro. |
| Kinase-Assay |
Sondierung der Proteasome-Aktivität in Zellextrakten
|
|
Menschliche multiple Myelomzellen werden zweimal mit kalter phosphatgepufferter Salzlösung gewaschen, pelletiert und mit einem Volumen Glasperlen (<106 Mikrometer, säuregewaschen) und einem gleichen Volumen Homogenisierungspuffer (50 mM Tris (pH 7,4), 1 mM Dithiothreit, 5 mM MgCl2, 2 mM ATP und 250 mM Saccharose) durch Vortexen bei hoher Geschwindigkeit für 15-30 Minuten bei 4 °C lysiert. Perlen, Membranfraktionen, Kerne und Zelltrümmer werden dann aus dem Überstand durch Zentrifugation bei 16.000 g für 5 Minuten entfernt. Der Proteingehalt der Extrakte wird mit dem Bradford-Assay quantifiziert. Die Proteasome-Aktivität wird wie unten beschrieben untersucht. Gleiche Mengen (typischerweise 60 g) Protein werden durch Kochen in reduzierendem Probenpuffer denaturiert, durch 12,5% SDS-PAGE getrennt und auf Polyvinylidendifluorid (PVDF)-Membranen elektrotransferiert. Immunoblotting wird unter Verwendung eines Dansyl-Sulfonamidohexanoyl-polyklonalen Antikörpers (1:7.500, Kaninchen) und eines Meerrettichperoxidase-gekoppelten Ziegen- oder Schweine-Anti-Kaninchen-Sekundärantikörpers, gefolgt von verbesserter Chemilumineszenz, durchgeführt.
|
|
| In vivo |
CEP-18770 zeigt eine anhaltende dosisabhängige relative Tumorgewichtsinhibition. CEP-18770 führt zu dosisabhängigen vollständigen Tumorregressionen, was zu einer 50%igen Inzidenz von CR bei seiner maximal verträglichen Dosis (MTD) von 1,2 mg/kg intravenös führt. CEP-18770 zeigt eine dosisabhängige Zunahme der Inzidenz von tumorfreien Mäusen bis zum Abschluss dieser Studien (120 Tage nach Tumortransplantation). Die orale Verabreichung von CEP-18770 führt zu einer deutlichen Abnahme des Tumorgewichts und einer bemerkenswerten dosisabhängigen Inzidenz vollständiger Tumorregression mit minimalen Änderungen des Tierkörpergewichts im Verlauf der 120-Tage-Studien. Equiactive Dosen von CEP-18770 zeigen eine größere und anhaltendere dosisabhängige Hemmung der Tumor-Proteasome-Aktivität, die zeitlich mit der maximalen Induktion der Caspase-3- und 7-Aktivität korrespondiert. Das maximale apoptotische Signal ist für CEP-18770 2,5-fach größer. Im Gegensatz dazu sind die Proteasome-Inhibitionsprofile von CEP-18870 in den untersuchten normalen peripheren Mausgeweben (Leber, Lunge, Vollblut und Gehirn [keine Aktivität]) sowohl in ihrer Größe als auch in ihrer Dauer vergleichbar. Zu keinem Zeitpunkt wurde in Gehirngewebe eine Proteasome-Inhibition für CEP-18770 oder festgestellt. Einzelwirkstoff CEP-18770 PO zeigt auch deutliche Anti-MM-Effekte in diesen Xenograft-Modellen |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01348919 | Completed | Multiple Myeloma |
Teva Branded Pharmaceutical Products R&D Inc. |
August 3 2011 | Phase 1|Phase 2 |
| NCT01023880 | Terminated | Multiple Myeloma |
Cephalon|Teva Branded Pharmaceutical Products R&D Inc. |
January 2010 | Phase 1|Phase 2 |
| NCT00572637 | Completed | Solid Tumors|Lymphoma Non-Hodgkin |
Ethical Oncology Science |
November 2007 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
