nur für Forschungszwecke
Neratinib (HKI-272) HER2/EGFR Inhibitor
Kat.-Nr.S2150
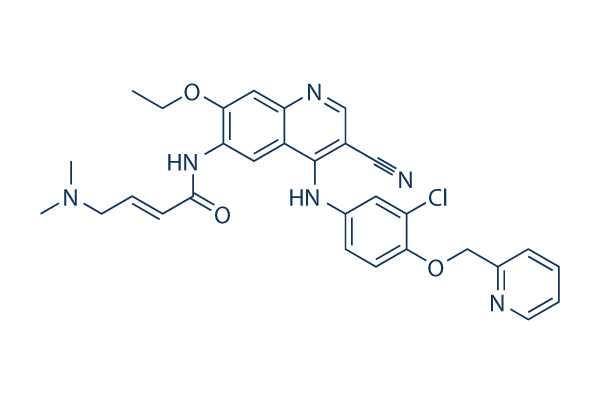
Chemische Struktur
Molekulargewicht: 557.04
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 c-Kit |
|---|---|
| Weitere HER2 Inhibitoren | CP-724714 Sapitinib (AZD8931) Mubritinib (TAK 165) AC480 (BMS-599626) Tyrphostin AG 879 HER2-Inhibitor-1 TAS0728 Zongertinib |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| BT-474 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| EFM-192A | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| HCC1569 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| HCC1954 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| MDA-MB-175 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| MDA-MB-361 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| SK-BR-3 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| UACC-812 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| UACC-893 | Growth Inhibition Assay | IC50<0.005 μM | 24009064 | |||
| SUM-225 | Growth Inhibition Assay | IC50=0.01 μM | 24009064 | |||
| SUM-190 | Growth Inhibition Assay | IC50=0.01 μM | 24009064 | |||
| ZR-75-1 | Growth Inhibition Assay | IC50=0.03 μM | 24009064 | |||
| HCC70 | Growth Inhibition Assay | IC50=0.03 μM | 24009064 | |||
| BT-20 | Growth Inhibition Assay | IC50=0.07 μM | 24009064 | |||
| MDA-MB-453 | Growth Inhibition Assay | IC50=0.09 μM | 24009064 | |||
| HCC1187 | Growth Inhibition Assay | IC50=0.10 μM | 24009064 | |||
| EFM-19 | Growth Inhibition Assay | IC50=0.11 μM | 24009064 | |||
| T-47D | Growth Inhibition Assay | IC50=0.16 μM | 24009064 | |||
| MDA-MB-134 | Growth Inhibition Assay | IC50=0.17 μM | 24009064 | |||
| HCC38 | Growth Inhibition Assay | IC50=0.25 μM | 24009064 | |||
| MDA-MB-435 | Growth Inhibition Assay | IC50=0.33 μM | 24009064 | |||
| MDA-MB-468 | Growth Inhibition Assay | IC50=0.33 μM | 24009064 | |||
| CAMA-1 | Growth Inhibition Assay | IC50=0.37 μM | 24009064 | |||
| MDA-MB-436 | Growth Inhibition Assay | IC50=0.41 μM | 24009064 | |||
| MCF-7 | Growth Inhibition Assay | IC50=0.41 μM | 24009064 | |||
| MDA-MB-415 | Growth Inhibition Assay | IC50=0.42 μM | 24009064 | |||
| HCC1806 | Growth Inhibition Assay | IC50=0.44 μM | 24009064 | |||
| HCC1395 | Growth Inhibition Assay | IC50=0.49 μM | 24009064 | |||
| HCC1937 | Growth Inhibition Assay | IC50=0.50 μM | 24009064 | |||
| HCC1143 | Growth Inhibition Assay | IC50=0.54 μM | 24009064 | |||
| UACC-732 | Growth Inhibition Assay | IC50=0.65 μM | 24009064 | |||
| MDA-MB-231 | Growth Inhibition Assay | IC50=1.00 μM | 24009064 | |||
| MDA-MB-157 | Growth Inhibition Assay | IC50=1.12 μM | 24009064 | |||
| BT-549 | Growth Inhibition Assay | IC50=1.14 μM | 24009064 | |||
| KPL-1 | Growth Inhibition Assay | IC50=1.89 μM | 24009064 | |||
| CAL-51 | Growth Inhibition Assay | IC50=1.89 μM | 24009064 | |||
| BT474 | Growth Inhibition Assay | IC50=0.00323 ± 0.00075 μM | 23816254 | |||
| SKBR3 | Growth Inhibition Assay | IC50=0.0075 ± 0.005 μM | 23816254 | |||
| MDAMB453 | Growth Inhibition Assay | IC50=1.59 ± 0.179 μM | 23816254 | |||
| KB | Growth Inhibition Assay | IC50=4.13 ± 0.47 μM | 22491935 | |||
| KBv200 | Growth Inhibition Assay | IC50=6.03 ± 0.64 μM | 22491935 | |||
| MCF-7 | Growth Inhibition Assay | IC50=3.30 ± 0.41 μM | 22491935 | |||
| MCF-7/Adr | Growth Inhibition Assay | IC50= 2.88 ± 0.30 μM | 22491935 | |||
| MCF-7 | Growth Inhibition Assay | IC50=3.02 ± 0.34 μM | 22491935 | |||
| MCF-7/FLV1000 | Growth Inhibition Assay | IC50=7.09 ± 0.71 μM | 22491935 | |||
| HL60 | Growth Inhibition Assay | IC50=2.26 ± 0.23 μM | 22491935 | |||
| HL60/Adr | Growth Inhibition Assay | IC50=1.42 ± 0.15 μM | 22491935 | |||
| HEK293/pcDNA3.1 | Growth Inhibition Assay | IC50=5.29 ± 0.53 μM | 22491935 | |||
| HEK293/ABCB1 | Growth Inhibition Assay | IC50=6.91 ± 0.70 μM | 22491935 | |||
| SKBR | Growth Inhibition Assay | 0.01-100 nM | 3-7 d | inhibits cell growth in time and dose dependent manner | 21487605 | |
| L858R(EGFR) | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| L858R/T790M(EGFR) | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| G776insV_G/C | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| wild-type | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| A775insYVMA | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| G776insV_G/L | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| P780insGSP | Cell Viability Assay | decreases cell viability in time and dose dependent manner | 17311002 | |||
| NCI-H1781 | Growth Inhibition Assay | inhibits cell growth in time and dose dependent manner | 16818618 | |||
| HCC827 | Growth Inhibition Assay | inhibits cell growth in time and dose dependent manner | 16818618 | |||
| H3255 | Growth Inhibition Assay | inhibits cell growth in time and dose dependent manner | 16818618 | |||
| NCI-H1975 | Growth Inhibition Assay | inhibits cell growth in time and dose dependent manner | 16818618 | |||
| A549 | Growth Inhibition Assay | inhibits cell growth in time and dose dependent manner | 16818618 | |||
| 3T3 | Growth Inhibition Assay | IC50=700 ± 78 nM | 15173008 | |||
| 3T3/neu | Growth Inhibition Assay | IC50=3 ± 0.14 nM | 15173008 | |||
| SK-Br-3 | Growth Inhibition Assay | IC50=2 ± 0.18 nM | 15173008 | |||
| BT 474 | Growth Inhibition Assay | IC50=2 ± 0.06 nM | 15173008 | |||
| A431 | Growth Inhibition Assay | IC50=81 ± 9 nM | 15173008 | |||
| MDA-MB-435 | Growth Inhibition Assay | IC50=960 ± 165 nM | 15173008 | |||
| SW620 | Growth Inhibition Assay | IC50=690 ± 84 nM | 15173008 | |||
| SKBR3 | Function assay | Inhibition of human Her2 in SKBR3 cells, EC50 = 0.002 μM. | 18077425 | |||
| BT474 | Function assay | Inhibition of human Her2 in BT474 cells, EC50 = 0.002 μM. | 18077425 | |||
| A431 | Function assay | Inhibition of human Her2 in A431 cells, EC50 = 0.081 μM. | 18077425 | |||
| SW620 | Function assay | Inhibition of human Her2 in SW620 cells, EC50 = 0.69 μM. | 18077425 | |||
| BA/F3 | Cytotoxicity assay | Cytotoxicity against mouse BA/F3 cells expressing EGFR L858R mutant, IC50 = 0.0035 μM. | 19239229 | |||
| BA/F3 | Cytotoxicity assay | Cytotoxicity against mouse BA/F3 cells expressing EGFR L858R/T790M mutant, IC50 = 0.18 μM. | 19239229 | |||
| Sf9 | Function assay | 10 mins | Inhibition of human wild type EGFR expressed in Sf9 cells using [gamma32P]-ATP after 10 mins by scintillation counting, IC50 = 0.0025 μM. | 24900643 | ||
| Sf9 | Function assay | 10 mins | Inhibition of human EGFR T790M/L858R mutant expressed in Sf9 cells using [gamma32P]-ATP after 10 mins by scintillation counting, IC50 = 0.066 μM. | 24900643 | ||
| BAF3 | Function assay | 72 hrs | Inhibition of Tel-fused IGF1R (unknown origin) expressed in mouse BAF3 cells assessed as growth inhibition after 72 hrs by CellTiter-Glo assay, GI50 = 0.19 μM. | 28282122 | ||
| BAF3 | Function assay | 72 hrs | Inhibition of Tel-fused INSR (unknown origin) expressed in mouse BAF3 cells assessed as growth inhibition after 72 hrs by CellTiter-Glo assay, GI50 = 0.29 μM. | 28282122 | ||
| BAF3 | Growth inhibition assay | 72 hrs | Growth inhibition of mouse BAF3 cells after 72 hrs by CellTiter-Glo assay, GI50 = 1.9 μM. | 28282122 | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 557.04 | Formel | C30H29ClN6O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 698387-09-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | HKI-272 | Smiles | CCOC1=C(C=C2C(=C1)N=CC(=C2NC3=CC(=C(C=C3)OCC4=CC=CC=N4)Cl)C#N)NC(=O)C=CCN(C)C | ||
Löslichkeit
|
In vitro |
DMSO
: 6 mg/mL
(10.77 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
HER2
(Cell-free assay) 59 nM
EGFR
(Cell-free assay) 92 nM
KDR
(Cell-free assay) 800 nM
Src
(Cell-free assay) 1.4 μM
|
|---|---|
| In vitro |
Neratinib hemmt die Tyrosinkinasen KDR und Src schwach mit IC50-Werten von 0,8 μM bzw. 1,4 μM, was einer 14- bzw. 24-fach geringeren Aktivität im Vergleich zu HER2 entspricht. Diese Verbindung zeigt keine Aktivität gegen andere Serin-Threonin-Kinasen wie Akt, Cyclin D1/cdk4, Cyclin E/cdk2, Cyclin B1/cdk1, IKK-2, MK-2, PDK1, c-Raf und Tpl-2, sowie die Tyrosinkinase c-Met. Es hemmt selektiv die Proliferation von 3T3-Zellen, die mit dem HER2 (3T3/neu) transfiziert sind, sowie von zwei anderen HER-2-überexprimierenden SK-Br-3- und BT474-Zellen mit IC50-Werten von 2-3 nM, was eine >230-fache Potenz im Vergleich zu nicht-transfizierten 3T3-Zellen sowie MDA-MB-435 und SW620, die EGFR- und HER2-negativ sind, zeigt. Diese Chemikalie hemmt auch die Proliferation von EGFR-abhängigen A431-Zellen mit einem IC50 von 81 nM. Sie reduziert die HER2-Rezeptor-Autophosphorylierung in BT474-Zellen mit einem IC50 von 5 nM und die EGF-abhängige Phosphorylierung von EGFR in A431-Zellen mit einem IC50 von 3 nM. Die Blockierung von HER-2 durch diese Verbindung führt zur Hemmung der nachgeschalteten MAPK- und Akt-Signalwege mit einem IC50 von 2 nM, was potenter ist als Trastuzumab. Es hemmt die Cyclin-D1-Expression und die Phosphorylierung des Rb-Suszeptibilitätsgenprodukts in BT474-Zellen mit einem IC50 von 9 nM, was zu einem G1-S-Arrest und letztendlich einer verminderten Zellproliferation führt.
|
| Kinase-Assay |
Zellfreier Autophosphorylierungs-Assay mittels zeitaufgelöster Fluorometrie
|
|
Neratinib wird als 10 mg/mL Stammlösung in DMSO hergestellt und in 25 mM HEPES (pH 7,5; 0,002 ng/mL-20 μg/mL) verdünnt. Gereinigte rekombinante COOH-terminale Fragmente von HER2 (Aminosäuren 676-1255) oder epidermalem Wachstumsfaktorrezeptor (EGFR) (Aminosäuren 645-1186) [verdünnt in 100 mM HEPES (pH 7,5) und 50 % Glycerin] werden mit steigenden Konzentrationen dieser Verbindung in 4 mM HEPES (pH 7,5), 0,4 mM MnCl2, 20 μM Natriumvanadat und 0,2 mM DTT für 15 Minuten bei Raumtemperatur in 96-Well-ELISA-Platten inkubiert. Die Kinase-Reaktion wird durch die Zugabe von 40 μM ATP und 20 mM MgCl2 initiiert und für 1 Stunde bei Raumtemperatur fortgesetzt. Die Platten werden gewaschen, und die Phosphorylierung wird unter Verwendung Europium-markierter Anti-Phospho-Tyrosin-Antikörper (15 ng/Well) nachgewiesen. Nach den Wasch- und Anreicherungsschritten wird das Signal mit einem Victor2-Fluoreszenzleser (Anregungswellenlänge 340 nm, Emissionswellenlänge 615 nm) detektiert. Die Konzentration dieser Chemikalie, die die Rezeptorphosphorylierung um 50 % hemmt (IC50), wird aus den Hemmkurven berechnet.
|
|
| In vivo |
Die orale Verabreichung von Neratinib hemmt signifikant das Wachstum von 3T3/neu-Xenografts, mit einer Hemmung von 34 %, 53 %, 98 % und 98 % bei Dosen von 10, 20, 40 und 80 mg/kg/Tag. In Übereinstimmung mit der Hemmung der HER-2-Phosphorylierung um 84 % innerhalb von 1 Stunde nach Verabreichung von 40 mg/kg/Tag hemmt diese Verbindung das Wachstum von BT474-Xenografts um 70-82 %, 67 % und 93 % bei Dosen von 5, 10 und 40 mg/kg/Tag. Es ist auch wirksam gegen SK-OV-3-Xenografts mit einer Hemmung von 31 % und 85 % bei 5 bzw. 60 mg/kg/Tag. Diese Chemikalie ist weniger potent gegen EGFR-abhängige A431-Xenografts als gegen HER-2-abhängige Tumoren, mit 32 % und 44 % Hemmung bei 5 bzw. 20 mg/kg/Tag. Sie zeigt wenig Aktivität gegen MCF-7- und MX-1-Xenografts, die niedrige Mengen an HER-2 und EGFR exprimieren, mit nur 28 % Hemmung bei 80 mg/kg/Tag, was darauf hindeutet, dass sie eine selektive Aktivität für Zellen aufweist, die HER-2 oder EGFR exprimieren.
|
Literatur |
Anwendungen
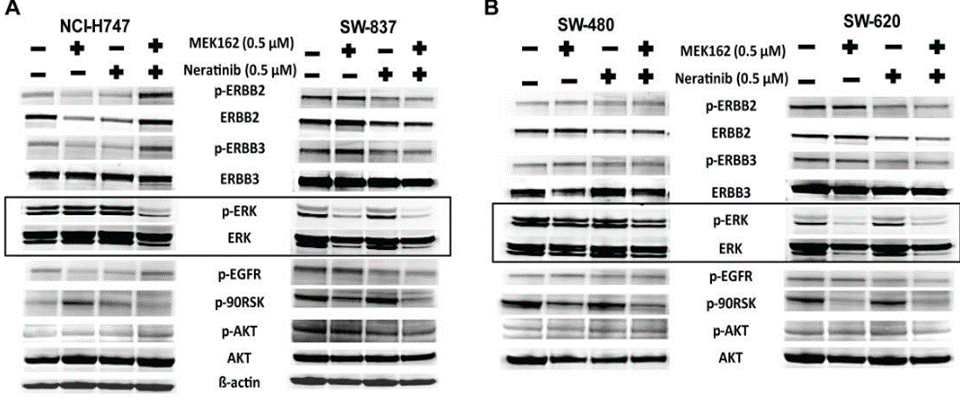
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | p-ERBB2 / ERBB2 / p-ERBB3 / ERBB3 / p-EGFR / p-90RSK pHER2 / HER2 / pAKT / AKT / pERK / ERK |
|
30118499 |
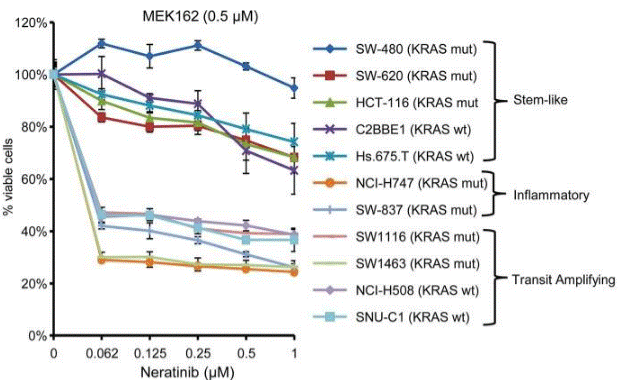
| Growth inhibition assay | Cell viability |
|
30118499 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05388149 | Recruiting | Breast Cancer|HER2-positive Breast Cancer |
University Health Network Toronto |
December 6 2022 | Phase 2 |
| NCT05252988 | Recruiting | Early-stage Breast Cancer|HER2 Positive Breast Cancer|Hormone Receptor Positive |
Spanish Breast Cancer Research Group|Puma Biotechnology Inc.|Pierre Fabre Laboratories |
August 31 2022 | Phase 2 |
| NCT04856475 | Withdrawn | Breast Cancer|Brain Metastases |
Jules Bordet Institute |
November 24 2021 | Phase 2 |
| NCT04781374 | Withdrawn | Metastatic Prostate Adenocarcinoma|Castration-resistant Prostate Cancer|Prostate Cancer|Prostate Cancer Metastatic |
Beth Israel Deaconess Medical Center|Puma Biotechnology Inc.|Dana-Farber Cancer Institute |
May 21 2021 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
