nur für Forschungszwecke
SAR131675 VEGFR3-Inhibitor
Kat.-Nr.S2842
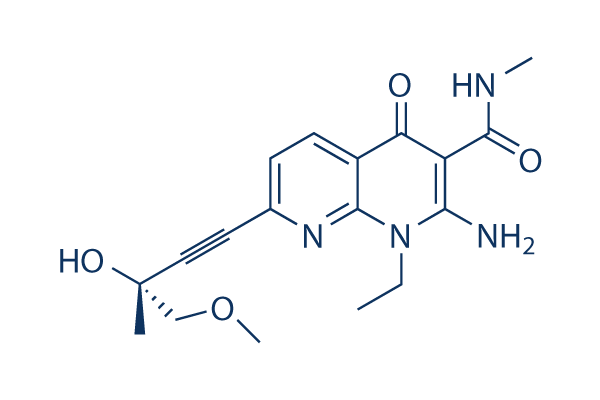
Chemische Struktur
Molekulargewicht: 358.39
Qualitätskontrolle
| Verwandte Ziele | EGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere VEGFR Inhibitoren | SU 5402 Cediranib (AZD2171) Vatalanib (PTK787) 2HCl Anlotinib (AL3818) Dihydrochloride Linifanib (ABT-869) Apatinib (YN968D1) Apatinib (YN968D1) mesylate Ki8751 ZM 323881 HCl Semaxanib (SU5416) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 358.39 | Formel | C18H22N4O4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1433953-83-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CCN1C(=C(C(=O)C2=C1N=C(C=C2)C#CC(C)(COC)O)C(=O)NC)N | ||
Löslichkeit
|
In vitro |
DMSO
: 72 mg/mL
(200.89 mM)
Ethanol : 4 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
A potent and selective VEGFR-3–tyrosine kinase inhibitor.
|
|---|---|
| Targets/IC50/Ki |
VEGFR3
(Cell-free assay) 23 nM
|
| In vitro |
SAR131675 hemmt dosisabhängig die Proliferation primärer menschlicher lymphatischer Zellen, die durch die VEGFR-3-Liganden VEGFC und VEGFD induziert wird, mit einer IC50 von etwa 20 nM. Diese Verbindung hemmt dosisabhängig die rh-VEGFR-3-TK-Aktivität mit einer IC50 von 23 nM. Sie hemmt die VEGR-3-TK-Aktivität mit einem Ki von etwa 12 nM. Sie hemmt die VEGFR-1-TK-Aktivität mit einer IC50 von > 3 μM und die VEGFR-2-TK-Aktivität mit einer IC50 von 235 nM. Sie hemmt die VEGFR-1-Autophosphorylierung mit einer IC50 von etwa 1 μM und die VEGFR-2-Autophosphorylierung mit einer IC50 von etwa 280 nM. Sie hemmt moderat VEGFR-2 und hat sehr geringe Auswirkungen auf VEGFR-1, was eine gute Selektivität für VEGFR-3 zeigt. Sie hemmt die VEGFA-induzierte VEGFR-2-Phosphorylierung dosisabhängig mit einer IC50 von 239 nM. Sie hemmt potent das Überleben lymphatischer Zellen, das durch VEGFC und VEGFD induziert wird, mit IC50 von 14 nM bzw. 17 nM. Sie hemmt das VEGFA-induzierte Überleben mit einer IC50 von 664 nM. Sie hemmt signifikant und dosisabhängig die VEGFC-induzierte Erk-Phosphorylierung mit einer IC50 von etwa 30 nM. |
| Kinase-Assay |
Tyrosine kinase assay
|
|
Multiwellplatten werden mit einem synthetischen Polymersubstrat Poly-Glu-Tyr (polyGT 4:1) vorbeschichtet. Die Reaktion wird in Gegenwart von Kinasepuffer (10 ×: 50 mM HEPES-Puffer, pH 7,4, 20 mM MgCl2, 0,1 mM MnCl2 und 0,2 mM Na3VO4), ergänzt mit ATP und Dimethylsulfoxid (DMSO) für die Positivkontrolle (C+) oder SAR131675 (im Bereich von 3 nM–1.000 nM) durchgeführt. ATP wird bei 30 μM für VEGFR-1 und VEGFR-3 und bei 15 μM für VEGFR-2 verwendet. Das phosphorylierte Poly-GT wird mit einem Phosphotyrosin-spezifischen monoklonalen Antikörper (mAb) nachgewiesen, der an Meerrettichperoxidase (HRP; 1/30.000) konjugiert ist, und im Dunkeln mit dem HRP-chromogenen Substrat (OPD) entwickelt. Die Reaktion wird dann durch Zugabe von 100 μL 1,25 M H2SO4 gestoppt, und die Absorption wird mit einem Envision-Spektrophotometer bei 492 nm bestimmt.
|
|
| In vivo |
In der embryonalen Angiogenese unter Verwendung des Zebrafischmodells beeinträchtigt SAR131675 die embryonale Vaskulogenese effizient. Diese Verbindung in einer Dosis von 100 mg/kg/Tag hat die Spiegel von VEGFR-3 und den Hämoglobingehalt um etwa 50 % signifikant reduziert. Sie hebt die in vivo durch FGF2 induzierte Lymphangiogenese und Angiogenese effizient auf. Diese Chemikalie ist in einer Dosis von 300 mg/kg in der Lage, sowohl die VEGFR-2- als auch die VEGFR-3-Signalgebung zu hemmen. In der Präventionsstudie wird eine 5-wöchige Behandlung mit dieser Verbindung gut vertragen, und die Anzahl der angiogenen Inseln in der Bauchspeicheldrüse von mit SAR131675 behandelten Mäusen ist im Vergleich zur Vehikel-behandelten Gruppe signifikant um 42 % reduziert. In der Interventionsstudie führt die tägliche orale Verabreichung dieser Chemikalie von Woche 10 bis Woche 12,5 zu einer signifikanten Abnahme der Tumorlast um 62 %. Die Behandlung damit reduziert das Tumorvolumen um 24 % und 50 % bei 30 mg/kg/Tag bzw. 100 mg/kg/Tag signifikant. |
Literatur |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
