nur für Forschungszwecke
SU 5402 Tyrosinkinase-Inhibitor
Kat.-Nr.S7667
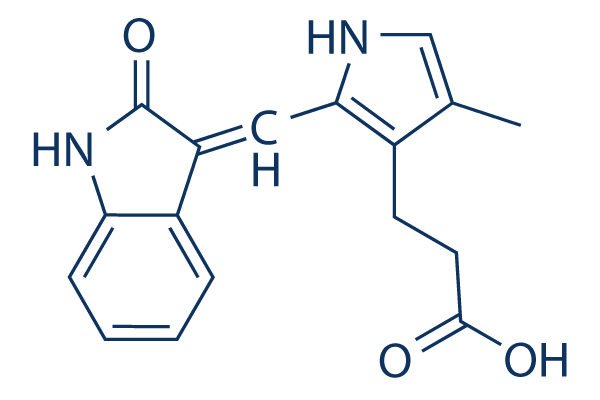
Chemische Struktur
Molekulargewicht: 296.32
Qualitätskontrolle
| Verwandte Ziele | EGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere VEGFR Inhibitoren | SAR131675 Cediranib (AZD2171) Vatalanib (PTK787) 2HCl Anlotinib (AL3818) Dihydrochloride Linifanib (ABT-869) Apatinib (YN968D1) Apatinib (YN968D1) mesylate Ki8751 ZM 323881 HCl Semaxanib (SU5416) |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| HUVEC or NIH3T3 | Function assay | Evaluated for the inhibition of cell proliferation induced by VEGF in HUVEC or NIH3T3 cells, IC50=0.05μM | 10893303 | |||
| HUVEC or NIH3T3 | Function assay | Evaluated for the inhibition of cell proliferation induced by FGF in HUVEC or NIH3T3 cells, IC50=2.8μM | 10893303 | |||
| NIH/3T3 | Function assay | Inhibition of acidic FGF-stimulated FGFR1 tyrosine autophosphorylation in mouse NIH/3T3 cells by immunoblotting, IC50=10μM | 9139660 | |||
| NIH 3T3 | Function assay | 5 mins | Inhibition of FGF induced FGFR1 autophosphorylation in mouse NIH 3T3 cells preincubated for 5 mins followed by FGF-stimulation for 5 mins in presence of [gamma-32P]ATP by SDS-PAGE based autoradiography, IC50=10μM | 27914362 | ||
| HUVEC or NIH3T3 | Function assay | Evaluated for the inhibition of cell proliferation induced by PDGF in HUVEC or NIH3T3 cells, IC50=28.4μM | 10893303 | |||
| NIH/3T3 | Growth inhibition assay | Growth inhibition of mouse NIH/3T3 cells assessed as inhibition of acidic FGF-stimulated [3H]thymidine incorporation | 9139660 | |||
| NIH/3T3 | Function assay | Inhibition of FGFR1 in mouse NIH/3T3 cells assessed as inhibition of aFGF-stimulated pp90 phosphoprotein phosphorylation by immunoblotting | 9139660 | |||
| NIH/3T3 | Function assay | Inhibition of FGFR1 in mouse NIH/3T3 cells assessed as inhibition of acidic FGF-stimulated ERK1 phosphorylation by immunoblotting | 9139660 | |||
| NIH/3T3 | Function assay | Inhibition of FGFR1 in mouse NIH/3T3 cells assessed as inhibition of acidic FGF-stimulated ERK2 phosphorylation by immunoblotting | 9139660 | |||
| NIHIR | Function assay | Inhibition of insulin-stimulated insulin receptor beta subunit autophosphorylation in mouse NIHIR cells | 9139660 | |||
| HER14 | Function assay | Inhibition of EGF-stimulated EGFR phosphorylation in mouse HER14 cells by immunoblotting | 9139660 | |||
| HER14 | Function assay | Inhibition of EGFR in mouse HER14 cells assessed as inhibition of EGF-stimulated Shc phosphorylation by immunoblotting | 9139660 | |||
| HER14 | Function assay | Inhibition of EGFR in mouse HER14 cells assessed as inhibition of EGF-stimulated ERK2 activation by immunoblotting | 9139660 | |||
| NIHIR | Function assay | Inhibition of insulin receptor in mouse NIHIR cells assessed as inhibition of insulin-stimulated IRS1 phosphorylation | 9139660 | |||
| NIH/3T3 | Function assay | Inhibition of PDGFR in mouse NIH/3T3 cells assessed as inhibition of PDGF-stimulated tyrosine autophosphorylation by immunoblotting | 9139660 | |||
| NIH/3T3 | Function assay | Inhibition of PDGFR in mouse NIH/3T3 cells assessed as inhibition of PDGF-stimulated phospholipase C gamma phosphorylation by immunoblotting | 9139660 | |||
| NIH/3T3 | Function assay | Inhibition of PDGFR in mouse NIH/3T3 cells assessed as PDGF-stimulated Erk2 activation by immunoblotting | 9139660 | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 296.32 | Formel | C17H16N2O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 215543-92-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=CNC(=C1CCC(=O)O)C=C2C3=CC=CC=C3NC2=O | ||
Löslichkeit
|
In vitro |
DMSO
: 59 mg/mL
(199.1 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
VEGFR2
(Cell-free assay) 20 nM
FGFR1
(Cell-free assay) 30 nM
PDGFRβ
(Cell-free assay) 510 nM
|
|---|---|
| In vitro |
SU5402 hemmt die VEGF-, FGF-, PDGF-abhängige Zellproliferation mit einer IC50 von 0,05 μM, 2,80 μM bzw. 28,4 μM. In HUVECs hemmt diese Verbindung selektiv die VEGF-getriebene Mitogenese dosisabhängig mit einer IC50 von 0,04 μM. In nasopharyngealen Epithelzellen dämpft sie die LMP1-vermittelte aerobe Glykolyse, zelluläre Transformation, Zellmigration und Invasion. In Maus-C3H10T1/2-Zellen verringert diese Chemikalie die Wirkung von FGF23 auf die Zelldifferenzierung.
|
| Kinase-Assay |
FGF-R1- und Flk-1/KDR-Kinase-Assays.
|
|
Der katalytische Teil von FGF-R1 und Flk-1/KDR wird als GST-Fusionsproteine nach Infektion von Spodoptera frugiperda (sf9)-Zellen mit gentechnisch veränderten Baculoviren exprimiert. GST-FGFR1 und GST-Flk1 werden aus infizierten sf9-Zelllysaten durch Glutathion-Sepharose-Chromatographie zur Homogenität gereinigt. Die Assays werden in 96-Well-Mikrotiterplatten durchgeführt, die über Nacht mit 2,0 μg eines PolyGlu-Tyr-Peptids (4:1) in 0,1 ml PBS pro Well beschichtet worden waren. Die gereinigten Kinasen werden in Kinase-Assay-Puffer (100 mM Hepes pH 7,5, 100 mM NaCl und 0,1 mM Natriumorthovanadat) verdünnt und zu allen Testwells in einer Menge von 5 ng GST-Fusionsprotein pro 0,05 ml Volumen Puffer gegeben. Testverbindungen werden in 4% DMSO verdünnt und zu den Testwells (0,025 ml/Well) gegeben. Die Kinase-Reaktion wird durch Zugabe von 0,025 ml 40 μM ATP/40 mM MnCl2 gestartet, und die Platten werden 10 Minuten lang geschüttelt, bevor die Reaktionen durch Zugabe von 0,025 ml 0,5 M EDTA gestoppt werden. Die finale ATP-Konzentration betrug 10 μM, was dem Doppelten des experimentell bestimmten Km-Wertes für ATP entspricht. Negative Kontrollwells erhalten nur MnCl2 ohne ATP. Die Platten werden dreimal mit 10 mM Tris pH 7,4, 150 mM NaCl und 0,05% Tween-20 (TBST) gewaschen. Kaninchen-polyklonales Anti-Phosphotyrosin-Antiserum wird in einer 1:10000-Verdünnung in TBST für 1 Stunde zu den Wells gegeben. Die Platten werden dann dreimal mit TBST gewaschen. Ziegen-Anti-Kaninchen-Antiserum, konjugiert mit Meerrettichperoxidase, wurde dann für 1 Stunde zu allen Wells gegeben. Die Platten werden dreimal mit TBST gewaschen, und die Peroxidase-Reaktion wird durch Zugabe von 2,2'-Azinobis(3-ethylbenzthiazolin-6-sulfonsäure) (ABTS) detektiert. Die Farbauslesung des Assays darf sich 20-30 Minuten lang entwickeln und wird auf einem Dynatech MR5000 ELISA-Plattenlesegerät mit einem 410 nM Testfilter abgelesen.
|
|
| In vivo |
Bei Mäusen hemmt SU5416 (25 mg/kg, i.p.) das subkutane Wachstum einer Reihe von Tumorzelllinien durch Hemmung des mit dem Tumorwachstum verbundenen angiogenen Prozesses.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
