nur für Forschungszwecke
Semaxanib (SU5416) VEGFR2-Inhibitor
Kat.-Nr.S2845
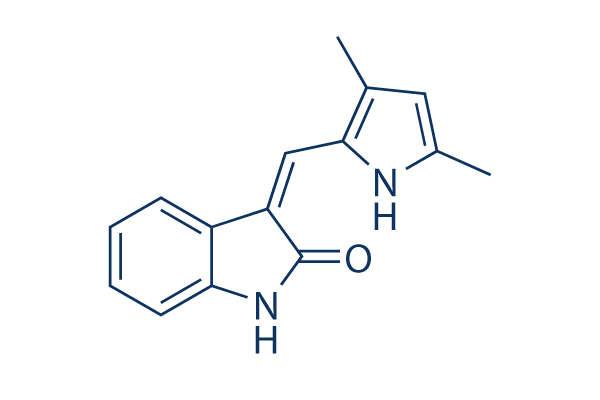
Chemische Struktur
Molekulargewicht: 238.28
Qualitätskontrolle
| Verwandte Ziele | EGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere VEGFR Inhibitoren | SAR131675 SU 5402 Cediranib (AZD2171) Vatalanib (PTK787) 2HCl Anlotinib (AL3818) Dihydrochloride Linifanib (ABT-869) Apatinib (YN968D1) Apatinib (YN968D1) mesylate Ki8751 ZM 323881 HCl |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| MCF7 cells | Cytotoxicity assay | 48 h | Cytotoxicity against human MCF7 cells after 48 hrs by CCK8 assay, IC50=3.1 nM | |||
| mouse B16F10 cells | Cytotoxicity assay | 48 h | Cytotoxicity against mouse B16F10 cells after 48 hrs by CCK8 assay, IC50=3.6 nM | |||
| human U251 cells | Function assay | Inhibition of VEGFR2 in human U251 cells by phosphotyrosine ELISA, IC50=12.9 nM | ||||
| human A431 cells | Function assay | Antiangiogenic activity against human A431 cells, IC50=0.085 μM | ||||
| CHO cells | Function assay | Inhibition of VEGFR induced autophosphorylation of human Vascular endothelial growth factor receptor 2 (VEGFR2) transfected in CHO cells, IC50=0.884 μM | ||||
| human MCF7 cells | Proliferation assay | 4 days | Antiproliferative activity against human MCF7 cells after 4 days by coulter counter method, IC50=1.9 μM | |||
| human SF539 cells | Function assay | Inhibition of PDGFRbeta in human SF539 cells by phosphotyrosine ELISA, IC50=2.4 μM | ||||
| A431 cells | Function assay | Inhibition of VEGFR2 expressed in human A431 cells, IC50=12.9 μM | ||||
| HUVEC cells | Proliferation assay | 72 h | Antiproliferative activity against human HUVEC cells assessed as reduction in cell viability after 72 hrs by trypan blue assay, GI50=13.6 μM | |||
| human HMEC1 cells | Proliferation assay | 7 days | Antiproliferative activity against human HMEC1 cells after 7 days by coulter counter method, IC50=15 μM | |||
| human HeLa cells | Proliferation assay | 4 days | Antiproliferative activity against human HeLa cells after 4 days by coulter counter method, IC50=20 μM | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 238.28 | Formel | C15H14N2O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 204005-46-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | semaxinib | Smiles | CC1=CC(=C(N1)C=C2C3=CC=CC=C3NC2=O)C | ||
Löslichkeit
|
In vitro |
DMSO
: 17 mg/mL
(71.34 mM)
Ethanol : 2 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
VEGFR2/Flk1
(Cell-free assay) 1.23 μM
|
|---|---|
| In vitro |
Semaxanib (SU5416) hemmt die VEGF-abhängige Phosphorylierung des Flk-1-Rezeptors in Flk-1-überexprimierenden NIH 3T3-Zellen mit einem IC50-Wert von 1,04 μM und die PDGF-abhängige Autophosphorylierung in NIH 3T3-Zellen mit einem IC50-Wert von 20,3 μM. Es hemmt auch die VEGF- und FGF-getriebene Mitogenese dosisabhängig mit IC50-Werten von 0,04 bzw. 50 μM. Die Behandlung mit dieser Verbindung hat keine Auswirkung auf das In-vitro-Wachstum von C6-Gliom-, Calu 6-Lungenkarzinom-, A375-Melanom-, A431-Epidermoidkarzinom- und SF767T-Gliomzellen (alle IC50-Werte > 20 μM).
|
| Kinase-Assay |
Biochemische Kinase-Assays
|
|
Solubilisierte Membranen von 3T3 Flk-1-Zellen werden zu Polystyrol-ELISA-Platten gegeben, die zuvor mit einem monoklonalen Antikörper beschichtet wurden, der Flk-1 erkennt. Nach einer Inkubation über Nacht mit Lysat bei 4 ℃ werden serielle Verdünnungen von Semaxanib (SU5416) zu dem immunlokalisierten Rezeptor gegeben. Um die Autophosphorylierung des Rezeptors zu induzieren, werden verschiedene ATP-Konzentrationen zu den ELISA-Plattenvertiefungen gegeben, die seriell verdünnte Lösungen dieser Verbindung enthalten. Die Autophosphorylierung lässt man 60 Minuten bei Raumtemperatur ablaufen und stoppt sie dann mit EDTA. Die Menge an Phosphotyrosin, die auf den Flk-1-Rezeptoren in den einzelnen Vertiefungen vorhanden ist, wird durch Inkubation des immunlokalisierten Rezeptors mit einem biotinylierten monoklonalen Antikörper gegen Phosphotyrosin bestimmt. Nach Entfernung des ungebundenen Anti-Phosphotyrosin-Antikörpers wird Avidin-konjugierte Meerrettichperoxidase H zu den Vertiefungen gegeben. Eine stabilisierte Form von 3,3 9,5,5 9-Tetramethylbenzidindihydrochlorid und H2O2 wird zu den Vertiefungen gegeben. Der Farbausschlag des Assays wird 30 Minuten lang entwickelt, und die Reaktion wird mit H2SO4 gestoppt.
|
|
| In vivo |
Semaxanib (SU5416) hemmt dosisabhängig das Wachstum des A375-Tumors in vivo. Eine >85%ige Hemmung des subkutanen Tumorwachstums wird bei täglicher i.p.-Verabreichung dieser Verbindung in DMSO beobachtet, ohne messbare Toxizität. Es zeigt ein breites Spektrum an Antitumoraktivität, indem es das subkutane Wachstum von 8 der 10 getesteten Tumorlinien (A431, Calu-6, C6, LNCAP, EPH4-VEGF, 3T3HER2, 488G2M2 und SF763T-Zellen) mit einer durchschnittlichen Mortalitätsrate von 2,5 % signifikant hemmt. Bei 25 mg/kg/Tag zeigt es eine starke antiangiogene Aktivität, die zu einer signifikanten Reduktion sowohl der gesamten als auch der funktionellen vaskulären Dichte der Tumormikrogefäße führt.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
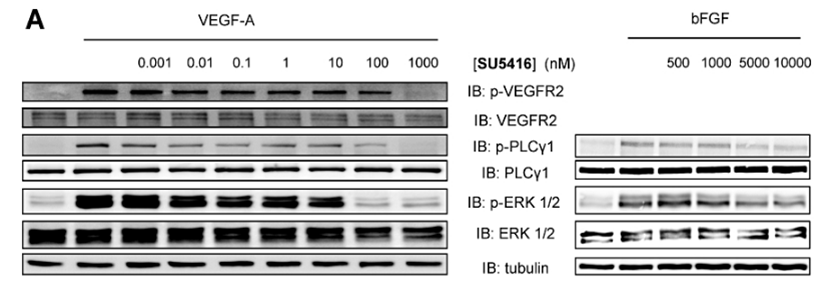
| Western blot | p-VEGFR2 / VEGFR2 / p-PLCγ1 / PLCγ1 / p-ERK / ERK |
|
21699503 |
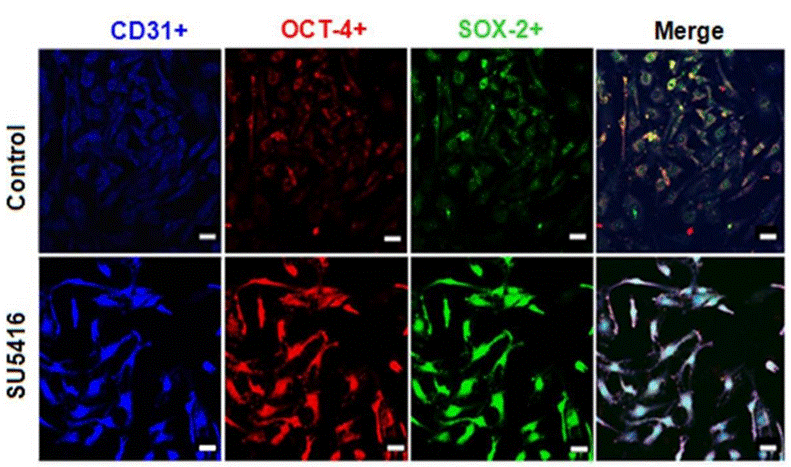
| Immunofluorescence | CD31 / OCT-4 / SOX-2 |
|
25665868 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00006247 | Terminated | Brain and Central Nervous System Tumors |
Pediatric Brain Tumor Consortium|National Cancer Institute (NCI) |
August 2000 | Phase 1 |
| NCT00005642 | Completed | Unspecified Adult Solid Tumor Protocol Specific |
Case Comprehensive Cancer Center|National Cancer Institute (NCI) |
May 2000 | Phase 1 |
| NCT00005647 | Completed | Head and Neck Cancer |
Case Comprehensive Cancer Center|National Cancer Institute (NCI) |
May 2000 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
