nur für Forschungszwecke
T0070907 PPARγ Antagonist
Kat.-Nr.S2871
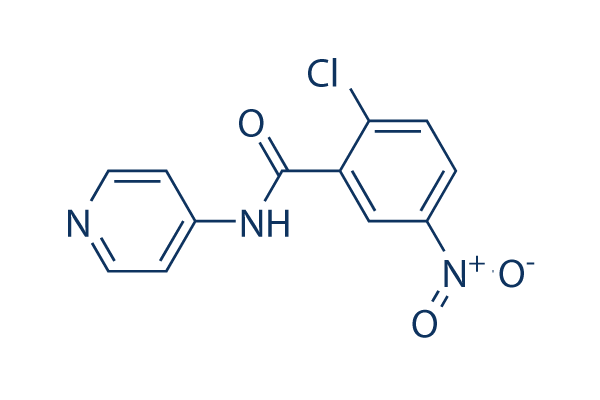
Chemische Struktur
Molekulargewicht: 277.66
Qualitätskontrolle
| Verwandte Ziele | HDAC PARP ATM/ATR DNA-PK WRN DNA/RNA Synthesis Topoisomerase Sirtuin Casein Kinase eIF |
|---|---|
| Weitere PPAR Inhibitoren | GW9662 GW6471 WY-14643 (Pirinixic Acid) GSK3787 GW0742 AZ6102 Harmine Astaxanthin Eupatilin GSK0660 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| OR6 | Cytotoxicity assay | 72 hrs | Cytotoxicity against african green monkey OR6 cells after 72 hrs by WST1 assay, CC50=2.7μM. | 23891183 | ||
| OR6 | Antiviral assay | 72 hrs | Antiviral activity against HCV infected in african green monkey OR6 cells assessed as inhibition of viral RNA replication after 72 hrs by luciferase reporter gene assay, ED50=4.9μM. | 23891183 | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 277.66 | Formel | C12H8ClN3O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 313516-66-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1=CC(=C(C=C1[N+](=O)[O-])C(=O)NC2=CC=NC=C2)Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 55 mg/mL
(198.08 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PPARγ
|
|---|---|
| In vitro |
T0070907 ist ein potenter und selektiver PPARγ-Antagonist. Mit einer scheinbaren Bindungsaffinität von 1 nM modifiziert diese Verbindung kovalent PPARγ an Cystein 313 in Helix 3 des menschlichen PPARγ2. Es blockiert die PPARγ-Funktion sowohl in zellbasierten Reportergen- als auch in Adipozyten-Differenzierungsassays. Im Einklang mit seiner Rolle als Antagonist von PPARγ blockiert diese Chemikalie die Agonist-induzierte Rekrutierung von Coaktivator-abgeleiteten Peptiden zu PPARγ in einem homogenen zeitaufgelösten Fluoreszenz-basierten Assay und fördert die Rekrutierung des transkriptionellen Corepressors NCoR zu PPARγ sowohl in Glutathion-S-Transferase-Pull-down-Assays als auch in einem PPARγ/Retinoid-X-Rezeptor (RXR) α-abhängigen Gel-Shift-Assay. Studien mit mutierten Rezeptoren deuten darauf hin, dass es die Interaktion von PPARγ mit diesen Kofaktorproteinen moduliert, indem es die Konformation von Helix 12 der Ligandenbindungsdomäne von PPARγ beeinflusst. Interessanterweise, während die T0070907-induzierte NCoR-Rekrutierung zum PPARγ/RXRα-Heterodimer durch die gleichzeitige Behandlung mit dem RXRα-Agonisten LGD1069 fast vollständig umgekehrt werden kann, hat diese Verbindung nur geringe Auswirkungen auf die LGD1069-induzierte Coaktivator-Rekrutierung zum PPARγ/RXRα-Heterodimer. Diese chemische Behandlung hemmt Proliferation, Invasion und Migration, beeinflusst aber die Apoptose nicht signifikant. Die molekulare Hemmung unter Verwendung eines dominant-negativen (Δ462)-Rezeptors führt zu ähnlichen Ergebnissen. Sie vermittelt auch eine dosisabhängige Abnahme der Phosphorylierung von PPARγ und seiner Fähigkeit, an DNA zu binden, und kann die Mitogen-aktivierte Proteinkinase-Signalgebung direkt beeinflussen. |
| Kinase-Assay |
Ligandenbindungsassay
|
|
Um die Bindungsaffinität von T0070907 zu den PPARs zu bestimmen, wird ein Szintillationsnäherungsassay (SPA) mit den folgenden Modifikationen durchgeführt. Eine 90-μl-Reaktion enthält SPA-Puffer (10 mM KH2PO4, 10 mM KH2PO4, 2 mM EDTA, 50 mM NaCl, 1 mM Dithiothreitol, 2 mM CHAPS, 10 % (v/v) Glycerin, pH 7,1), 50 ng GST-PPARγ (oder 150 ng GST-PPARα, GST-PPARδ), 5 nM 3H-markierte Radioliganden und 5 μl dieser Verbindung in Me2SO. Nach Inkubation für 1 h bei Raumtemperatur werden 10 μl polylysinbeschichtete SPA-Beads (bei 20 mg/ml in SPA-Puffer) hinzugefügt, und die Mischung wird 1 h lang inkubiert, bevor sie in Packard Topcount abgelesen wird.
|
|
| In vivo |
Lipopolysaccharid-Vorkonditionierung schwächt die Entwicklung von Nierenfunktionsstörungen, hepatozellulären Schäden und Kreislaufversagen sowie den Anstieg der Plasmawerte von Interleukin-1 [beta], verursacht durch schwere Endotoxämie, signifikant ab. Diese Verbindung kann all diese positiven Effekte, die durch die Vorkonditionierung mit Lipopolysaccharid erzielt werden, abschwächen |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
