nur für Forschungszwecke
GW0742 PPAR Agonist
Kat.-Nr.S8020
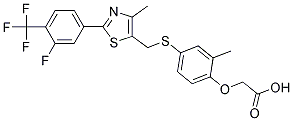
Chemische Struktur
Molekulargewicht: 471.49
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase Vitamin Carbohydrate Metabolism Mitochondrial Metabolism Drug Metabolite |
|---|---|
| Weitere PPAR Inhibitoren | T0070907 GW9662 GW6471 WY-14643 (Pirinixic Acid) GSK3787 AZ6102 Harmine Astaxanthin Eupatilin GSK0660 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| CV-1 cells | Function assay | 24 h | Agonist activity at mouse PPAR-alpha expressed in african green monkey CV-1 cells after 24 hrs by luciferase reporter gene assay | |||
| HEK293 cells | Function assay | Transactivation of PPARdelta (unknown origin) expressed in HEK293 cells co-transfected with PDK4-PPRE by luciferase reporter gene assay | ||||
| C2C12 cells | Function assay | 4 days | Agonist activity at PPARdelta in mouse C2C12 cells assessed as upregulation of TFAM gene expression after 4 days by real time PCR analysis | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 471.49 | Formel | C21H17F4NO3S2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 317318-84-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=C(C=CC(=C1)SCC2=C(N=C(S2)C3=CC(=C(C=C3)C(F)(F)F)F)C)OCC(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 94 mg/mL
(199.36 mM)
Ethanol : 44 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Both GW0742 and L-165041 activate PPARβ, but not PPARγ or PPARα in platelets.
|
|---|---|
| Targets/IC50/Ki |
PPARδ
1 nM(EC50)
|
| In vitro |
GW0742 zeigt in zellbasierten Transaktivierungsassays Aktivität gegen hPPARα, hPPARγ und hPPARδ mit EC50-Werten von 1,1 μM, 2 μM bzw. 1 nM. Diese Verbindung (0,2 μM und 1 μM) führt zu signifikanten Erhöhungen der Reporteraktivität von PPARβ/δ in N/TERT-1 Keratinozyten. Sie (1 μM) führt zu einer signifikanten Hemmung der durchschnittlichen Anzahl von N/TERT-1 Keratinozyten. Die Chemikalie (1 μM) führt zu einer Zunahme der Zellzahl in der G1-Phase und einer Abnahme der Zellzahl in der S-Phase. Sie (1 μM) verursacht einen signifikanten Anstieg der mRNA, die ADRP, ein bekanntes PPARβ/δ-Zielgen, kodiert, sowohl in N/TERT-1 Keratinozyten als auch in primären Mauskeratinozyten. Dieses Mittel (1 μM) führt zu einer signifikant reduzierten Phosphorylierung von Retinoblastom (Rb) und einem signifikant niedrigeren p42/44 ERK-Spiegel in N/TERT-1-Zellen. Es (1 μM) führt zu einem Anstieg der mRNA, die eine Reihe bekannter Marker der terminalen Differenzierung, einschließlich TG-I, SPR1A, K10 und Involucrin, kodiert. Diese Verbindung bei 100 μM bewirkt eine signifikante Reduktion des durch niedriges KCl induzierten neuronalen Zelltods in Kleinhirnkörnerneuronen. Sie bei 100 μM induziert nach 48 Stunden Inkubation eine ausgeprägte Zunahme des Zelltods, gemessen durch LDH-Freisetzung. Die Chemikalie bei 100 μM bewirkt nach 6 Stunden in Kleinhirnkörnerneuronen-Kulturen eine ausgeprägte Zunahme der c-Jun-Expression. Sie bei 100 μM erhöht die PPARα-vermittelte Transaktivierung, abhängig von der Anwesenheit von 1,5 % BSA in MCF-7-Zellen.
|
| In vivo |
GW0742 (10 mg/kg) fördert den reversen Cholesterintransport in C57BL6/J-Mäusen. Diese Verbindung (10 mg/kg) erhöht die fäkale Ausscheidung von HDL-Cholesterin, obwohl sie keinen Einfluss auf den HDL-Cholesterin-Katabolismus bei C57BL6/J-Mäusen hat. Sie verringert die NPC1L1-mRNA-Expression im Dünndarm von Mäusen. Diese Chemikalie (30 mg/kg) führt vor der Induktion einer LPS-vermittelten Lungenentzündung zu einem signifikanten Rückgang der Leukozytenrekrutierung in den Lungenraum bei männlichen BALB/c-Mäusen. Sie (30 mg/kg) verringert signifikant die Protein- und mRNA-Spiegel der proinflammatorischen Zytokine IL-6, IL-1beta und TNFalpha in der Bronchialalveolarlavageflüssigkeit von Mäusen.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
