nur für Forschungszwecke
WY-14643 (Pirinixic Acid) PPAR Aktivator
Kat.-Nr.S8029
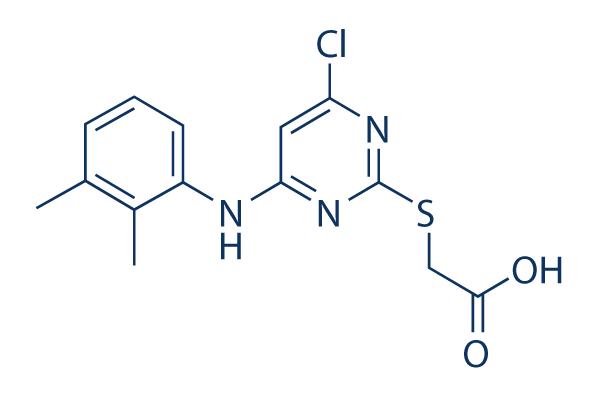
Chemische Struktur
Molekulargewicht: 323.8
Qualitätskontrolle
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase Vitamin Carbohydrate Metabolism Mitochondrial Metabolism Drug Metabolite |
|---|---|
| Weitere PPAR Inhibitoren | T0070907 GW9662 GW6471 GSK3787 GW0742 AZ6102 Harmine Astaxanthin Eupatilin GSK0660 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| Hep G2 cells | Function assay | Agonist activity at mouse PPARalpha ligand binding domain expressed in human Hep G2 cells co-transfected with Gal4-DBD by luciferase reporter gene assay, EC50=0.04 μM | ||||
| MCF7 cells | Function assay | Agonist activity at human PPARalpha expressed in MCF7 cells co-transfected CPTI DR1-type RE after 6 hrs by luciferase reporter gene assay, EC50=0.542 μM | ||||
| U2OS cells | Function assay | Agonist activity at human PPARalpha in U2OS cells by transactivation assay, EC50=12 μM | ||||
| HEK293 cells | Function assay | Agonist activity at human PPARalpha expressed in HEK293 cells cotransfected with PPREx4-TK-luc assessed as activation of luciferase activity measured after 48 hrs by transactivation assay, EC50=23.33 μM | ||||
| COS7 cells | Function assay | Activation of human PPARalpha ligand binding domain expressed in COS7 cells by luciferase reporter gene assay, IC50=36.3 μM | ||||
| EAhy926 cells | Function assay | 10 uM | 12 h | Inhibition of tube formation in human EAhy926 cells at 10 uM pre-incubated for 12 hrs measured after 24 hrs by phase-contrast microscopy | ||
| mouse NIH3T3 cells | Function assay | 0.1-10 μM | Transactivation of mouse recombinant PPARalpha expressed in mouse NIH3T3 cells at 0.1 uM to 10 uM by PPRE activation based dual luciferase reporter gene assay relative to control | |||
| HepaR cells | Function assay | 25 μM | 1 day | Agonist activity at PPARalpha in human HepaR cells assessed as increase in HMGCS2 gene expression at 25 uM incubated for 1 day by quantitative PCR method relative to untreated control | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 323.8 | Formel | C14H14ClN3O2S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 50892-23-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC 310038 | Smiles | CC1=C(C(=CC=C1)NC2=CC(=NC(=N2)SCC(=O)O)Cl)C | ||
Löslichkeit
|
In vitro |
DMSO
: 64 mg/mL
(197.65 mM)
Ethanol : 64 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PPARα
1.5 μM(EC50)
|
|---|---|
| In vitro |
WY 14643 (10 μM) hemmt die Interleukin-1-induzierte Produktion von Interleukin-6 und Prostaglandin sowie die Expression von Cyclooxygenase-2 in glatten Muskelzellen der Aorta fast vollständig, durch Repression der NF-κB-Signalübertragung. WY14643 (250 μM) reduziert die VCAM-1-Expressionsniveaus signifikant auf 52 % der TNF-α-stimulierten menschlichen Endothelzellen. Eine Vorbehandlung von Endothelzellen mit WY 14643 (10 μM) vor der TNF-α-Stimulation reduziert die U937-Zelladhäsion um 50 %. |
| In vivo |
Die Verabreichung von WY 14643 (1 mg/kg i.v. Bolus) 30 Minuten vor dem Verschluss der linken vorderen absteigenden Arterie führt zu einer signifikanten Reduzierung der Infarktgröße um ~44 % bei Ratten, die einer regionalen Myokardischämie (25 min) und Reperfusion (2 h) ausgesetzt waren. WY 14643 (3 mg/kg) senkt die basalen Plasmaspiegel von Glukose, Triglyceriden (-16 % vs. unbehandelt) und Leptin (-52 %) sowie Muskeltriglyceride (-34 %) und die gesamten langkettigen Acyl-CoAs (LCACoAs) (-41 %) bei Ratten, die fettreich ernährt wurden. WY14643 reduziert das viszerale Fettgewicht und den gesamten Lebertriglyceridgehalt erheblich, ohne die Gewichtszunahme zu erhöhen. WY14643 verbessert die Insulinempfindlichkeit des gesamten Körpers (die Glukoseinfusionsrate erhöht sich um 35 % und die Glukoseverfügbarkeit um 22 % im Vergleich zu unbehandelten Tieren). WY 14643 verbessert den insulinvermittelten Muskelglukose-Metabolismus-Index (Rg') in roten (47 %) und weißen (63 %) Muskeln sowie im weißen Fettgewebe (90 %) und reduziert die Akkumulation von Muskeltriglyceriden und LCACoA. |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
