nur für Forschungszwecke
KW-2449 FLT3 Inhibitor
Kat.-Nr.S2158
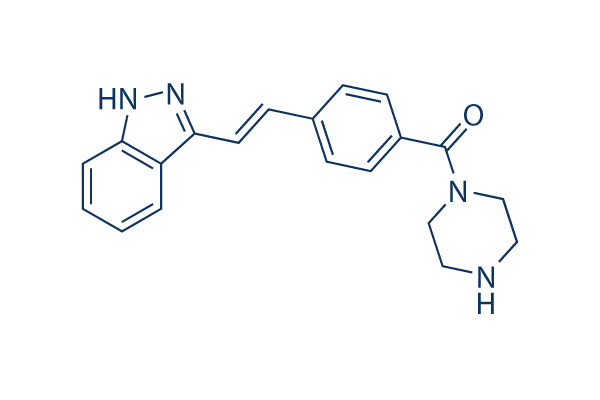
Chemische Struktur
Molekulargewicht: 332.4
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Weitere FLT3 Inhibitoren | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Dovitinib (TKI258) Lactate monohydrate Tandutinib (MLN518) ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 332.4 | Formel | C20H20N4O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1000669-72-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1CN(CCN1)C(=O)C2=CC=C(C=C2)C=CC3=NNC4=CC=CC=C43 | ||
Löslichkeit
|
In vitro |
DMSO
: 67 mg/mL
(201.56 mM)
Ethanol : 67 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Investigated as a FLT3 inhibitor in clinical trials, with others in early development.
|
|---|---|
| Targets/IC50/Ki |
FLT3 (D835Y)
(Cell-free assay) 1 nM
Abl (T315I)
(Cell-free assay) 4 nM
FLT3
(Cell-free assay) 6.6 nM
Abl
(Cell-free assay) 14 nM
FGFR1
(Cell-free assay) 36 nM
Aurora A
(Cell-free assay) 48 nM
JAK2
(Cell-free assay) 150 nM
Kit
(Cell-free assay) 300 nM
Src
(Cell-free assay) 400 nM
|
| In vitro |
KW-2449, ein Multikinase-Inhibitor von FLT3, ABL, ABL-T315I und Aurora Kinase, wird zur Behandlung von Leukämiepatienten untersucht. Diese Verbindung zeigt potente wachstumshemmende Effekte auf Leukämiezellen mit FLT3-Mutationen durch Hemmung der FLT3-Kinase, was zu einer Herunterregulierung von phosphoryliertem-FLT3/STAT5, G1-Arrest und Apoptose führt. Die orale Verabreichung dieser Chemikalie zeigt eine dosisabhängige und signifikante Tumorwachstumshemmung in einem FLT3-mutierten Xenotransplantationsmodell mit minimaler Knochenmarksuppression. Bei FLT3-Wildtyp-Humanleukämie induziert es die Reduktion von phosphoryliertem Histon H3, G2/M-Arrest und Apoptose. Bei Imatinib-resistenter Leukämie trägt dieser Wirkstoff zur Aufhebung der Resistenz durch die gleichzeitige Herunterregulierung von BCR/ABL und Aurora Kinases bei. Die hemmende Aktivität dieser Verbindung wird durch die Anwesenheit von menschlichem Plasmaprotein, wie α1-saures Glykoprotein, nicht beeinflusst. Es besitzt eine potente wachstumshemmende Aktivität gegen verschiedene Arten von Leukämie durch mehrere Wirkmechanismen. Dieser Inhibitor hat eine signifikante Aktivität und rechtfertigt klinische Studien bei Leukämiepatienten mit FLT3-Mutationen sowie Imatinib-resistenten Mutationen. Die Phosphorylierungsgrade von FLT3 und STAT5 werden durch diese Chemikalie dosisabhängig gesenkt. Darüber hinaus hemmt es potent ABL-T315I, das mit IM-Resistenz assoziiert ist, mit einem IC50 von 4 nM. Andererseits hat diese Verbindung selbst bei einer Konzentration von 1 μM wenig Einfluss auf PDGFRβ, IGF-1R, EGFR und verschiedene Serin/Threonin-Kinasen. Es besitzt potente wachstumshemmende Aktivitäten nicht nur gegen FLT3/ITD-exprimierende Leukämiezellen, sondern auch gegen FLT3/KDM-aktivierte und Wildtyp-FLT3-überexprimierende Leukämiezellen. In Übereinstimmung mit dem wachstumshemmenden Effekt unterdrückt dieser Wirkstoff die Phosphorylierungen von FLT3 (P-FLT3) und seinem nachgeschalteten Molekül Phospho-STAT5 (P-STAT5) in MOLM-13-Zellen dosisabhängig. Darüber hinaus erhöht es den Prozentsatz der Zellen in der G1-Phase des Zellzyklus und reduziert reziprok den Prozentsatz der Zellen in der S-Phase, was zu einer Zunahme der apoptotischen Zellpopulation führt. Diese Verbindung kann konstitutiv aktive WT-FLT3-Kinase dephosphorylieren, aber die Proliferation von Leukämiezellen nicht hemmen, wenn sie nicht hauptsächlich von der FLT3-Kinase abhängig sind. Es wird schnell resorbiert und zu einem Hauptmetaboliten M1 umgewandelt. Präklinische Studien zeigen, dass diese Chemikalie durch Monoaminoxidase-B (MAO-B) und Aldehydoxidase in ihren Hauptmetaboliten M1 umgewandelt wird. Dieser Wirkstoff vermittelt Zytotoxizität durch Hemmung von FLT3/ITD. Er ist ein direkter Inhibitor von FLT3 und induziert die Hemmung seines nachgeschalteten Ziels STAT5. Diese Verbindung interagiert synergistisch mit HDACI, um Apoptose in Ph+ CML-Zellen zeit- und konzentrationsabhängig zu induzieren. Sie verstärkt synergistisch die Letalität von Vorinostat/SNDX275 in CML-Zellen. Diese Inhibitor-Regime sind aktiv gegen zusätzliche IM-resistente Bcr/Abl+-Leukämiezellen. Es reduziert moderat die Phosphorylierung von Histon H3, ein Indikator für die Aurora B-Aktivität, in Nocodozol-behandelten K562-Zellen.
|
| Kinase-Assay |
FLT3-Phosphorylierung
|
|
Leukämiezellen werden in phosphatgepufferter Salzlösung (PBS) gewaschen und anschließend durch Resuspendieren der Zellen in Lysepuffer (20 mM Tris pH 7,4, 100 mM NaCl, 1 % Igepal, 1 mM EDTA, 2 mM NaVO4, plus Komplett-Proteaseinhibitor KW-2449 für 30 Minuten unter Schütteln) lysiert. Der Extrakt wird durch Zentrifugation bei 1,6 × 104 g geklärt und der Überstand auf Protein untersucht (Bio-Rad). Ein 50-μg-Aliquot wird als Ganzzelllysat zur Analyse von STAT5 entnommen, der Rest wird für die Immunpräzipitation mit Anti-FLT3 verwendet. Anti-FLT3-Antikörper wird dem Extrakt für eine Inkubation über Nacht zugesetzt, dann wird Protein A-Sepharose für weitere 2 Stunden hinzugefügt. Getrennte Natriumdodecylsulfat-Polyacrylamid-Elektrophorese-Gele (SDS-PAGE) für Ganzzelllysat und Immunpräzipitate werden parallel durchgeführt. Nach dem Transfer auf Immobilon-Membranen wird ein Immunoblotting mit Antiphosphotyrosin-Antikörper (4G10) durchgeführt, um phosphoryliertes FLT3 nachzuweisen, oder für die Ganzzelllysatgele mit einem monoklonalen Rattenantikörper gegen phosphoryliertes STAT5 (Rest Y694), dann abgestreift und mit Anti-FLT3-Antikörper re-probiert, um die Gesamt-FLT3 zu messen. Proteine werden mittels Chemilumineszenz visualisiert, auf Kodak BioMax XAR Film exponiert, entwickelt und mit einem Bio-Rad GS800 Densitometer gescannt. Die Konzentration dieser Verbindung, bei der die Phosphorylierung von FLT3 oder STAT5 auf 50 % des Ausgangswertes (IC50) gehemmt wird, wird mittels linearer Regressionsanalyse der Dosis-Wirkungs-Kurven bestimmt. Zur direkten Analyse von FLT3 und STAT5 in zirkulierenden Blasten wird peripheres Blut in heparinisierten Röhrchen gesammelt und umgehend auf Eis gekühlt. Die Proben werden 10 Minuten bei 900 g und 4 °C zentrifugiert. Das Plasma wird entfernt und bei -80 °C eingefroren gelagert. Der Buffy Coat wird vorsichtig in eiskaltes PBS überführt, auf gekühltes Ficoll-Hypaque geschichtet und 5 Minuten bei 600 g und 4 °C zentrifugiert. Alle weiteren Schritte werden bei 4 °C durchgeführt. Mononukleäre Zellen werden gesammelt und schnell einmal in Erythrozyten-Lysepuffer (0,155 M NH4Cl, 0,01 M KHCO3, 0,1 mM EDTA) gewaschen, dann einmal in PBS gewaschen. Die Zellen werden dann wie für die FLT3- und STAT5-Analyse beschrieben lysiert.
|
|
| In vivo |
Im MOLM-13-Tumorxenograftmodell zeigt die orale Verabreichung von KW-2449 über 14 Tage eine potente und signifikante Antitumorwirkung in dosisabhängiger Weise.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00346632 | Terminated | Acute Myelogenous Leukemia|Acute Lymphoblastic Leukemia|Myelodysplastic Syndromes|Chronic Myelogenous Leukemia |
Kyowa Kirin Inc. |
June 2006 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
