nur für Forschungszwecke
Dovitinib (TKI258) Lactate monohydrate FLT3 Inhibitor
Kat.-Nr.S7765
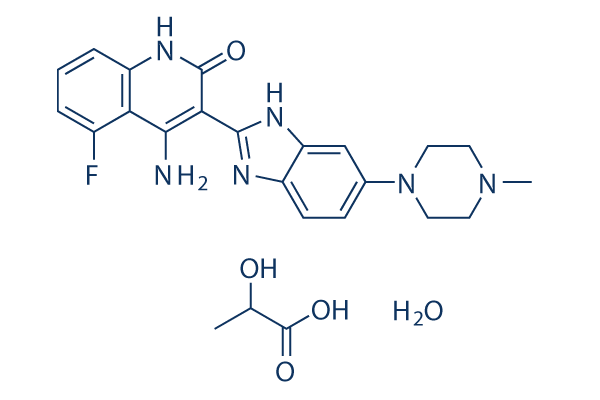
Chemische Struktur
Molekulargewicht: 500.52
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Weitere FLT3 Inhibitoren | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Tandutinib (MLN518) KW-2449 ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 500.52 | Formel | C24H29FN6O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 915769-50-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | CHIR258 | Smiles | CC(C(=O)O)O.CN1CCN(CC1)C2=CC3=C(C=C2)N=C(N3)C4=C(C5=C(C=CC=C5F)NC4=O)N.O | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(199.79 mM)
Water : 66 mg/mL Ethanol : 1 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
FLT3
1 nM
c-Kit
2 nM
FGFR1
8 nM
VEGFR3/FLT4
8 nM
FGFR3
9 nM
VEGFR1/FLT1
10 nM
VEGFR2/Flk1
13 nM
PDGFRβ
27 nM
CSF-1R/c-Fms
36 nM
|
|---|---|
| In vitro |
Dovitinib hemmt stark das FGF-stimulierte Wachstum von WT- und F384L-FGFR3-exprimierenden B9-Zellen mit einem IC50 von 25 nM. Darüber hinaus hemmt Dovitinib die Proliferation von B9-Zellen, die jede der verschiedenen aktivierten Mutanten von FGFR3 exprimieren. Interessanterweise gibt es minimale Unterschiede in der Empfindlichkeit der verschiedenen FGFR3-Mutationen gegenüber Dovitinib, wobei der IC50 für jede der verschiedenen Mutationen zwischen 70 und 90 nM liegt. IL-6-abhängige B9-Zellen, die nur Vektor enthalten (B9-MINV-Zellen), sind resistent gegen die hemmende Aktivität von Dovitinib bei Konzentrationen bis zu 1 μM. Dovitinib hemmt die Zellproliferation von KMS11 (FGFR3-Y373C), OPM2 (FGFR3-K650E) und KMS18 (FGFR3-G384D) Zellen mit einem IC50 von 90 nM (KMS11 und OPM2) bzw. 550 nM. Dovitinib hemmt die FGF-vermittelte ERK1/2-Phosphorylierung und induziert Zytotoxizität in FGFR3-exprimierenden primären MM-Zellen. BMSCs verleihen einen moderaten Grad an Resistenz mit 44,6 % Wachstumshemmung für Zellen, die mit 500 nM Dovitinib behandelt und auf Stroma kultiviert wurden, verglichen mit 71,6 % Wachstumshemmung für Zellen, die ohne BMSCs kultiviert wurden. Dovitinib hemmt die Proliferation von M-NFS-60, einer M-CSF-Wachstums-getriebenen Maus-myeloblastischen Zelllinie mit einer medianen effektiven Konzentration (EC50) von 220 nM. Die Behandlung von SK-HEP1-Zellen mit Dovitinib führt zu einer dosisabhängigen Reduktion der Zellzahl und einem G2/M-Phasenarrest mit Reduktion der G0/G1- und S-Phasen, Hemmung des Verankerungs-unabhängigen Wachstums und Blockierung der bFGF-induzierten Zellmotilität. Der IC50 für Dovitinib in SK-HEP1-Zellen beträgt ungefähr 1,7 μM. Dovitinib reduziert auch signifikant die basalen Phosphorylierungsspiegel von FGFR-1, FGFR-Substrat 2α (FRS2-α) und ERK1/2, aber nicht Akt in sowohl SK-HEP1- als auch 21-0208-Zellen. In 21-0208 HCC-Zellen hemmt Dovitinib signifikant die bFGF-induzierte Phosphorylierung von FGFR-1, FRS2-α, ERK1/2, aber nicht Akt. |
| Kinase-Assay |
In-vitro-Kinase-Assays
|
|
Die hemmende Konzentration von 50 % (IC50)-Werte für die Hemmung von RTKs durch Dovitinib werden in einem zeitaufgelösten Fluoreszenz- (TRF) oder radioaktiven Format bestimmt, wobei die Hemmung der Phosphatübertragung auf ein Substrat durch das entsprechende Enzym durch Dovitinib gemessen wird. Die Kinasedomänen von FGFR3, FGFR1, PDGFRβ und VEGFR1-3 werden in 50 mM HEPES (N-2-Hydroxyethylpiperazin-N'-2-ethansulfonsäure), pH 7,0, 2 mM MgCl2, 10 mM MnCl2, 1 mM NaF, 1 mM Dithiothreitol (DTT), 1 mg/mL Rinderserumalbumin (BSA), 0,25 μM biotinyliertem Peptidsubstrat (GGGGQDGKDYIVLPI) und 1 bis 30 μM Adenosintriphosphat (ATP) in Abhängigkeit von der Km für das jeweilige Enzym getestet. Die ATP-Konzentrationen liegen bei oder knapp unter Km. Für c-KIT- und FLT3-Reaktionen wird der pH-Wert auf 7,5 mit 0,2 bis 8 μM ATP in Gegenwart von 0,25 bis 1 μM biotinyliertem Peptidsubstrat (GGLFDDPSYVNVQNL) erhöht. Die Reaktionen werden 1 bis 4 Stunden bei Raumtemperatur inkubiert und das phosphorylierte Peptid auf Streptavidin-beschichteten Mikrotiterplatten, die Stoppreaktionspuffer (25 mM EDTA [Ethylendiamintetraessigsäure], 50 mM HEPES, pH 7,5) enthalten, eingefangen. Das phosphorylierte Peptid wird mit dem DELFIA TRF-System unter Verwendung eines Europium-markierten Antiphosphotyrosin-Antikörpers PT66 gemessen. Die Dovitinib-Konzentration für IC50 wird mittels nichtlinearer Regression mit der XL-Fit Datenanalysesoftware Version 4.1 (IDBS) berechnet. Die Hemmung der Kolonie-stimulierenden Faktor-1-Rezeptor (CSF-1R)-, PDGFRα-, Insulinrezeptor (InsR)- und Insulin-ähnlicher Wachstumsfaktor-Rezeptor 1 (IGFR1)-Kinaseaktivität wird bei ATP-Konzentrationen nahe der Km für ATP bestimmt.
|
|
| In vivo |
Dovitinib induziert in vivo sowohl zytostatische als auch zytotoxische Reaktionen, die zu einer Regression von FGFR3-exprimierenden Tumoren führen. Dovitinib zeigt eine dosis- und expositionsabhängige Hemmung von Ziel-Rezeptor-Tyrosinkinasen (RTKs), die in Tumorzell-Xenografts exprimiert werden. Dovitinib hemmt stark das Tumorwachstum von sechs HCC-Linien. Die Hemmung der Angiogenese korrelierte mit der Inaktivierung der FGFR/PDGFRβ/VEGFR2-Signalwege. In einem orthotopen Modell hemmt Dovitinib stark das primäre Tumorwachstum und die Lungenmetastasierung und verlängerte signifikant das Überleben der Mäuse. Die Verabreichung von Dovitinib führt zu einer signifikanten Hemmung des Tumorwachstums und zu Tumorregressionen, einschließlich großer, etablierter Tumoren (500-1.000 mm3). |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05571969 | Recruiting | Advanced Solid Tumors |
Allarity Therapeutics|Amarex Clinical Research |
February 20 2023 | Phase 1 |
| NCT02268435 | Withdrawn | Gastrointestinal Stromal Tumors |
Asan Medical Center |
March 2015 | Phase 1 |
| NCT01700270 | Completed | Advanced Solid Tumors Excluding Breast Cancer |
Novartis Pharmaceuticals|Novartis |
May 2013 | Phase 1 |
| NCT01680796 | Withdrawn | Multiple Myeloma |
University of Florida|Novartis Pharmaceuticals |
February 2013 | Phase 1 |
| NCT01266070 | Terminated | Von Hippel-Lindau Syndrome |
M.D. Anderson Cancer Center|Novartis |
November 2012 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
