nur für Forschungszwecke
NVP-ADW742 IGF-1R Inhibitor
Kat.-Nr.S1088
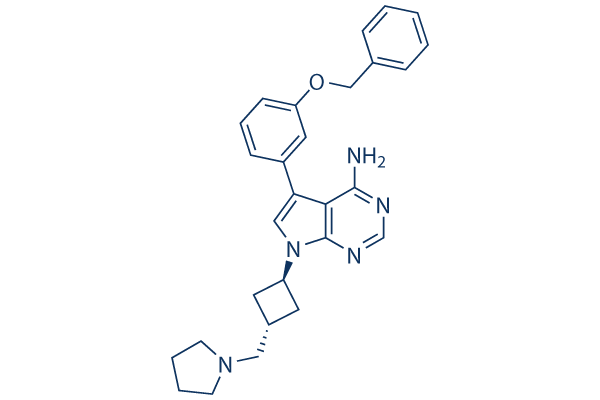
Chemische Struktur
Molekulargewicht: 453.58
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 |
|---|---|
| Weitere IGF-1R Inhibitoren | Linsitinib (OSI-906) BMS-536924 NVP-AEW541 BMS-754807 Picropodophyllin (AXL1717) GSK1904529A AG-1024 NT157 PQ 401 MSDC-0160 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| Sf21 cells | Function assay | Inhibition of human IGF1R expressed in Sf21 cells by time-resolved fluorescence assay, IC50=0.078 μM | ||||
| MiaPaCa2 cells | Function assay | Inhibition IGF1R phosphorylation in human MiaPaCa2 cells, IC50=0.323 μM | ||||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 453.58 | Formel | C28H31N5O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 475488-23-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | GSK 552602A, ADW742 | Smiles | C1CCN(C1)CC2CC(C2)N3C=C(C4=C(N=CN=C43)N)C5=CC(=CC=C5)OCC6=CC=CC=C6 | ||
Löslichkeit
|
In vitro |
DMSO
: 22 mg/mL
(48.5 mM)
Ethanol : 20 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
IGF-1R
(cellular autophosphorylation assays) 0.17 μM
|
|---|---|
| In vitro |
NVP-ADW742 zeigt eine 6-fach höhere Selektivität für IGF-1R gegenüber InsR mit einer IC50 von 2,8 μM; minimale Hemmaktivität gegen c-Kit, HER1, PDGFR, VEGFR2 oder Bcr-Abl p210 mit einer IC50 von mehr als 5 μM. Diese Verbindung hemmt die serumstimulierte Zellproliferation in einer Vielzahl von Tumorzelllinien dosisabhängig, mit IC50-Werten von 0,1-0,5 μM für die multiplen Myelom (MM)-Zelllinien, und die Antitumorwirkungen auf MM-Zellen können durch die Kokultur mit BMSCs nicht überwunden werden. Es hebt auch die Reaktionsfähigkeit von Tumorzellen auf IL-6 in Anwesenheit von Serum auf. Darüber hinaus ist diese Chemikalie aktiv gegen MM-Zelllinien mit Resistenzen gegen konventionelle (zytotoxische Chemotherapie) oder experimentelle (CC-5013, TRAIL/Apo2L, PS-341) Antikrebsmittel sowie primäre Tumorzellen von MM-Patienten mit multiresistenter Erkrankung. Diese Verbindung verringert die Produktion von VEGF durch Tumorzellen und Knochenmarkstromazellen und unterdrückt die IGF-1-induzierte VEGF-Sekretion durch verschiedene Tumortypen wie Schilddrüsenkrebszellen oder MM-Zellen. Die IGF-1R-Hemmung durch diese Verbindung (0,75 μM) sensibilisiert MM-Zellen oder Prostatakrebszellen für andere Antikrebsmittel wie Doxorubicin, TRAIL/Apo2L oder PS-341. |
| Kinase-Assay |
Assay zur zellulären Kinaseaktivität
|
|
Der IC50-Wert für die Wirkung von NVP-ADW742 auf die Autophosphorylierung von IGF-1R wird auf zellulärer Ebene in Anwesenheit zunehmender Konzentrationen dieser Verbindung unter Verwendung von 96-Well-„Capture ELISAs“-Assays bestimmt. Kurz gesagt, NWT-21-Zellen werden in 96-Well-Gewebekulturplatten in komplettem Wachstumsmedium ausgesät und bis zu einer Konfluenz von 70–80 % gezüchtet und anschließend 24 Stunden lang in 0,5 % FCS-Medium ausgehungert. Anschließend werden die Zellen 90 Minuten lang in Anwesenheit dieses Inhibitors inkubiert, gefolgt von der Stimulation mit IGF-I (10 ng/mL) für 10 Minuten bei 37 °C. Anschließend werden die Zellen zweimal mit eiskaltem PBS gewaschen und bei 4 °C mit 50 μL/Well RIPA-Puffer (50 mM Tris-HCl, pH 7,2, 120 mM NaCl, 1 mM EDTA, 6 mM EGTA, 1 % NP-40, 20 mM NaF, 1 mM Benzamidin, 15 mM Natriumpyrophosphat, 1 mM PMSF und 0,5 mM Na3VO4) lysiert. Die Lysate aus jedem Experiment werden dann auf schwarze ELISA-Platten übertragen, die mit Fängantikörpern spezifisch für IGF-1R vorbeschichtet sind. Nach der Einfangung durch die Antikörper werden die Lysate mit 40 μL eines alkalische Phosphatase (AP)-markierten Anti-Phosphotyrosin-Antikörpers (PY20(AP), verdünnt auf 0,2 μg/mL in RIPA-Puffer) gemischt und über Nacht bei 4 °C inkubiert. Nach dem Waschen (PBST) und der Inkubation für 45 Minuten bei RT mit dem lumineszierenden AP-Substrat CDPStar RTU mit Emerald II (90 μL/Well) wird die Lumineszenz mit einem Packard Top Count Scintillation Counter gemessen.
|
|
| In vivo |
Die Verabreichung von NVP-ADW742 in einer Dosis von 10 mg/kg zweimal täglich hemmt das Tumorwachstum signifikant, verlängert das Überleben und verstärkt die Antitumorwirkung der zytotoxischen Chemotherapie im Mausmodell des diffusen multiplen Myeloms. |
Literatur |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
