nur für Forschungszwecke
BGJ398 (Infigratinib) FGFR Inhibitor
Kat.-Nr.S2183
Chemische Struktur
Molekulargewicht: 560.48
Qualitätskontrolle
Produkte, die oft zusammen verwendet werden mit BGJ398 (Infigratinib)
| Verwandte Ziele | EGFR VEGFR JAK PDGFR Src HIF FLT FLT3 HER2 Bcr-Abl |
|---|---|
| Weitere FGFR Inhibitoren | PD173074 AZD4547 (Fexagratinib) BLU9931 Futibatinib (TAS-120) LY2874455 PD-166866 Zoligratinib (Debio-1347) H3B-6527 Fisogatinib (BLU-554) SSR128129E |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| HCC | Growth Inhibition Assay | 1-2500 nM | 48 h | IC50= 2359 nm | 25688743 | |
| HCC | Growth Inhibition Assay | 1-2500 nM | 48 h | IC50=1124 nm | 25688743 | |
| HCT116 | Growth Inhibition Assay | 48 h | IC50=3 μM | 24503538 | ||
| HKH2 | Growth Inhibition Assay | 48 h | IC50=4 μM | 24503538 | ||
| RKO | Growth Inhibition Assay | 48 h | IC50=1.2 μM | 24503538 | ||
| LS174T | Growth Inhibition Assay | 48 h | IC50=4 μM | 24503538 | ||
| HCD9 | Growth Inhibition Assay | 0.5-5 μM | 48/72 h | DMSO | decreases cell viability | 24135816 |
| HCT116 | Growth Inhibition Assay | 0.5-5 μM | 48/72 h | DMSO | decreases cell viability | 24135816 |
| SNU-C1 | Growth Inhibition Assay | 0.5-5 μM | 48/72 h | DMSO | no effect | 24135816 |
| MFE280 | Growth Inhibition Assay | IC50=2.63 ± 0.82 μM | 23443805 | |||
| AN3CA | Growth Inhibition Assay | IC50=1.00 ± 0.20 μM | 23443805 | |||
| HEC155 | Growth Inhibition Assay | IC50=4.74 ± 1.09 μM | 23443805 | |||
| MFE296 | Growth Inhibition Assay | IC50=2.86 ± 0.20 μM | 23443805 | |||
| SPAC1S | Growth Inhibition Assay | IC50=3.19 ± 0.93 μM | 23443805 | |||
| RL952 | Growth Inhibition Assay | IC50=3.41 ± 0.23 μM | 23443805 | |||
| EN1 | Growth Inhibition Assay | IC50=4.75 ± 0.62 μM | 23443805 | |||
| SNGII | Growth Inhibition Assay | IC50=4.29 ± 0.58 μM | 23443805 | |||
| ISHIKAWA | Growth Inhibition Assay | IC50=5.48 ± 0.03 μM | 23443805 | |||
| HEC1A | Growth Inhibition Assay | IC50=10.00 ± 1.00 μM | 23443805 | |||
| KLE | Growth Inhibition Assay | IC50=3.03 ± 0.11 μM | 23443805 | |||
| SNGM | Growth Inhibition Assay | IC50=5.00 ± 0.41 μM | 23443805 | |||
| USPC2 | Growth Inhibition Assay | IC50=7.00 ± 0.21 μM | 23443805 | |||
| EN | Growth Inhibition Assay | IC50=6.03 ± 0.31 μM | 23443805 | |||
| MFE319 | Growth Inhibition Assay | IC50=5.37 ± 0.03 μM | 23443805 | |||
| EFE184 | Growth Inhibition Assay | IC50=8.04 ± 0.69 μM | 23443805 | |||
| ECC1 | Growth Inhibition Assay | IC50=6.74 ± 0.59 μM | 23443805 | |||
| HEC1B | Growth Inhibition Assay | IC50=6.45 ± 0.67 μM | 23443805 | |||
| USPC1 | Growth Inhibition Assay | IC50=5.75 ± 0.50 μM | 23443805 | |||
| SPAC1L | Growth Inhibition Assay | IC50=4.92 ± 0.50 μM | 23443805 | |||
| HCC827 | Function assay | Displacement of [3H]-cyclopamine from SMO V404M mutant in gefitinib resistant human HCC827 cells by scintillation counting, Ki = 0.0465 μM. | 28787156 | |||
| SJ-GBM2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SJ-GBM2 cells | 29435139 | |||
| NB-EBc1 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB-EBc1 cells | 29435139 | |||
| sf9 | Function assay | 60 mins | Inhibition of non-phosphorylated N-terminal His6-tagged FGFR4 C552A mutant (G442 to E753 residues) (unknown origin) expressed in sf9 cells using 5-Fluo-Ahx-KKKKEEIYFFFG-NH2 as substrate after 60 mins by microfluidic mobility shift assay, IC50 = 0.00082 μM. | ChEMBL | ||
| sf9 | Function assay | 60 mins | Inhibition of wild type non-phosphorylated N-terminal His6-tagged FGFR4 (G442 to E753 residues) (unknown origin) expressed in sf9 cells using 5-Fluo-Ahx-KKKKEEIYFFFG-NH2 as substrate after 60 mins by microfluidic mobility shift assay, IC50 = 0.062 μM. | ChEMBL | ||
| sf9 | Function assay | 60 mins | Inhibition of non-phosphorylated N-terminal His6-tagged FGFR4 C477A mutant (G442 to E753 residues) (unknown origin) expressed in sf9 cells using 5-Fluo-Ahx-KKKKEEIYFFFG-NH2 as substrate after 60 mins by microfluidic mobility shift assay, IC50 = 0.064 μM. | ChEMBL | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 560.48 | Formel | C26H31Cl2N7O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 872511-34-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NVP-BGJ398 | Smiles | CCN1CCN(CC1)C2=CC=C(C=C2)NC3=CC(=NC=N3)N(C)C(=O)NC4=C(C(=CC(=C4Cl)OC)OC)Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 3 mg/mL
(5.35 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
FGFR1
(Cell-free assay) 0.9 nM
FGFR3
(Cell-free assay) 1.0 nM
FGFR2
(Cell-free assay) 1.4 nM
FGFR3 (K650E)
(Cell-free assay) 4.9 nM
FGFR4
(Cell-free assay) 60 nM
|
|---|---|
| In vitro |
Infigratinib (BGJ398) verhindert auch VEGFR2 mit geringer Potenz, mit einer IC50 von 0,18 μM zur Hemmung dieses Ziels. Es unterdrückt andere Kinasen, einschließlich ABL, FYN, KIT, LCK, LYN und YES mit IC50-Werten von 2,3 μM, 1,9 μM, 0,75 μM, 2,5 μM, 0,3 μM bzw. 1,1 μM. Auf zellulärer Ebene hemmt diese Verbindung die Proliferation der FGFR1-, FGFR2-Q- und FGFR3-abhängigen BaF3-Zellen mit einer IC50 von 2,9 μM, 2,0 μM bzw. 2 μM. Es stört die Autophosphorylierung an spezifischen Tyrosinresten, einschließlich FGFR-WT, FGFR2-WT, FGFR3-K650E, FGFR3-S249C und FGFR4-WT mit einer IC50 von 4,6 nM, 4,9 nM, 5 nM, 5 nM bzw. 168 nM. Zusätzlich unterdrückt es die Proliferation der Krebszellen mit Wildtyp (WT) FGFR3-Überexpression wie RT112, RT4, SW780 und JMSU1 mit einer IC50 von 5 nM, 30 nM, 32 nM bzw. 15 nM.
|
| Kinase-Assay |
Radiometrischer Kinase-Assay
|
|
Die enzymatische Kinaseaktivität wird durch Messung der Phosphorylierung eines synthetischen Substrats durch die gereinigte GST-Fusions-FGFR3-K650E-Kinasedomäne in Gegenwart von radiomarkiertem ATP bestimmt. Die Enzymaktivitäten werden gemessen, indem 10 μL einer 3-fach konzentrierten Lösung von Infigratinib (BGJ398) oder Kontrolle mit 10 μL der entsprechenden Substratmischung (peptidisches Substrat, ATP und [γ33P]ATP) gemischt werden. Die Reaktionen werden durch Zugabe von 10 μL einer 3-fach konzentrierten Enzymlösung in Assay-Puffer gestartet. Die Endkonzentrationen der Assay-Komponenten sind wie folgt: 10 ng GST-FGFR3-K650E, 20 mM Tris-HCl, pH 7,5, 3 mM MnCl2, 3 mM MgCl2, 1 mM DTT, 250 μg/mL PEG 20000, 2 μg/mL Poly(EY) 4:1, 1% DMSO und 0,5 μM ATP (γ-[33P]-ATP 0,1 μCi). Der Assay wird gemäß der Filterbindungs-(FB)-Methode in 96-Well-Platten bei Raumtemperatur für 10 Minuten in einem Endvolumen von 30 μL, einschließlich dieser Verbindung, durchgeführt. Die enzymatischen Reaktionen werden durch Zugabe von 20 μL 125 mM EDTA gestoppt, und die Inkorporation von 33P in die polypeptidischen Substrate wird wie folgt quantifiziert: 30 μL des gestoppten Reaktionsgemisches werden auf Immobilon-PVDF-Membranen übertragen, die zuvor 5 Minuten lang mit Methanol getränkt, mit Wasser gespült, 5 Minuten lang mit 0,5% H3PO4 getränkt und auf einem Vakuummanifold mit getrennter Vakuumquelle montiert wurden. Nach dem Auftragen wird das Vakuum angeschlossen und jede Vertiefung mit 0,5% H3PO4 (200 μL) gespült. Freie Membranen werden entfernt und viermal auf einem Schüttler mit 1% H3PO4 und einmal mit Ethanol gewaschen. Die Membranen werden getrocknet und mit Zugabe von 10 μL/Vertiefung einer Szintillationsflüssigkeit überschichtet. Die Platten werden schließlich versiegelt und in einem Mikrotiterplatten-Szintillationszähler gezählt. IC50-Werte werden durch lineare Regressionsanalyse der prozentualen Hemmung berechnet.
|
|
| In vivo |
In diesem orthotopen Xenograft-Blasenkrebsmodell induziert BGJ398 nach oraler Verabreichung über 12 aufeinanderfolgende Tage in Dosen von 10 bzw. 30 mg/kg eine Tumorwachstumshemmung und Stase. Interessanterweise zeigen die Tiere, die diese Verbindung erhielten, entweder keinen Gewichtsverlust (10 mg/kg) oder eine Gewichtszunahme von 10% (30 mg/kg), ein weiterer Hinweis auf die Wirksamkeit. RT112-Tumor-tragende und weibliche Rowett-Ratten erhalten eine einmalige orale Verabreichung des Monophosphatsalzes von Infigratinib (BGJ398) in Dosen von 4,25 und 8,51 mg/kg. Es reduziert die Spiegel von pFRS2 und pMAPK signifikant dosisabhängig. Zusätzlich hemmt es signifikant die bFGF-stimulierte Angiogenesis dosisabhängig. Es beeinträchtigt jedoch nicht die VEGF-induzierte Blutgefäßbildung.
|
Literatur |
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | pFGFR1 / FGFR1 / pFRS2 / FRS2 / MEK / ERK p-YAP (S127) / YAP Mcl-1 Cyclin D1 / Cyclin A / Cyclin B / γ-H2AX / Cleaved caspase-9 / PARP Snail / Slug / ZEB1 p-FRS2 / FRS2 / p-AKT / AKT / p-ERK / ERK |
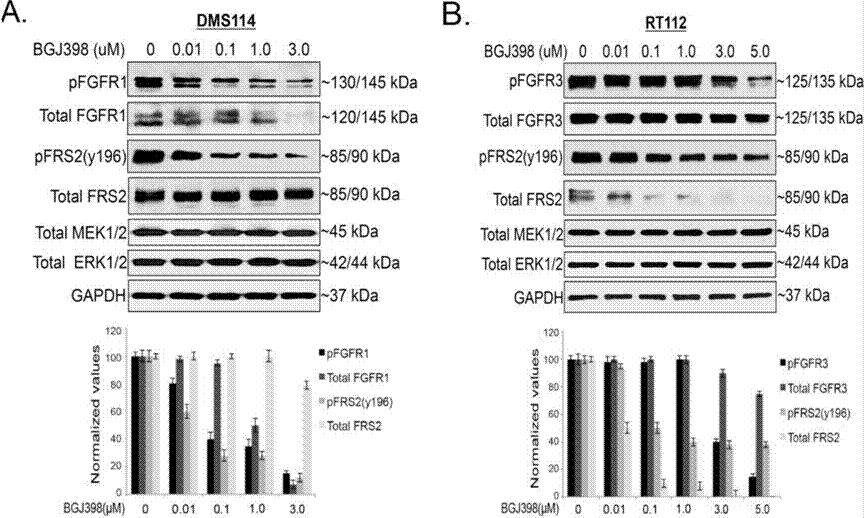
|
28255027 |
| Immunofluorescence | YAP |
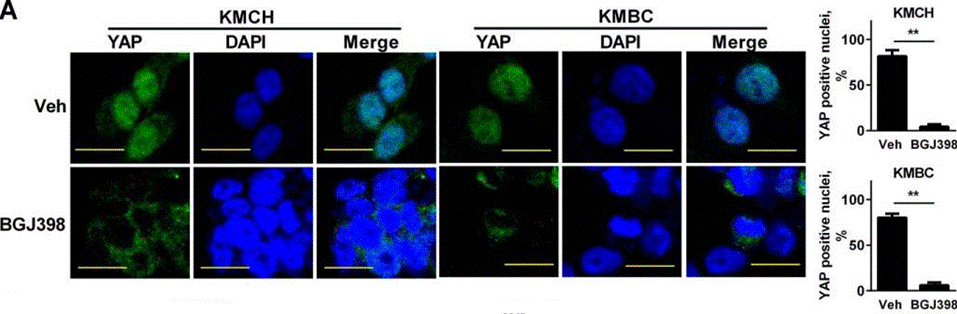
|
26826125 |
| Growth inhibition assay | Cell viability IC50 |
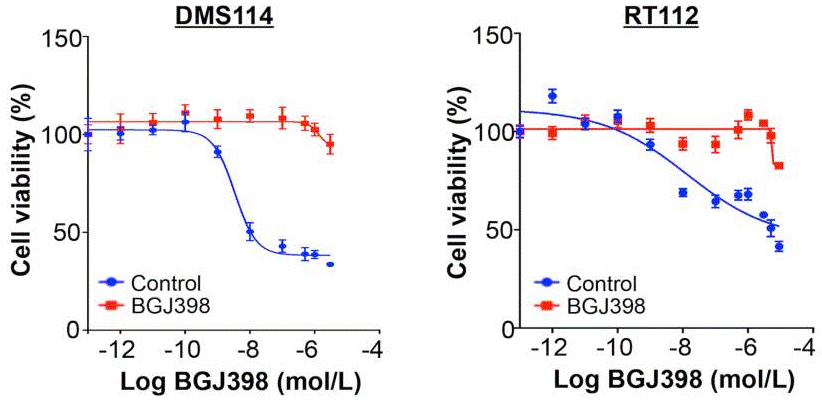
|
28255027 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03510455 | Terminated | Tumor-Induced Osteomalacia|Oncogenic Osteomalacia |
National Institute of Dental and Craniofacial Research (NIDCR)|National Institutes of Health Clinical Center (CC) |
February 27 2019 | Phase 2 |
| NCT02312804 | Withdrawn | Cancer of Cervix|Tumors |
The University of Texas Health Science Center at San Antonio |
January 2015 | Phase 1 |
| NCT02160041 | Terminated | Solid Tumor|Hematologic Malignancies |
Novartis Pharmaceuticals|Novartis |
July 24 2014 | Phase 2 |
| NCT01928459 | Completed | Advanced Solid Tumors|Metastatic Solid Tumors |
Novartis Pharmaceuticals|Novartis |
October 2013 | Phase 1 |
| NCT01004224 | Completed | Advanced Solid Tumors With Alterations of FGFR1 2 and or 3|Squamous Lung Cancer With FGFR1 Amplification|Bladder Cancer With FGFR3 Mutation or Fusion|Advanced Solid Tumors With FGFR1 Amplication|Advanced Solid Tumors With FGFR2 Amplication|Advanced Solid Tumors With FGFR3 Mutation |
Novartis Pharmaceuticals|Novartis |
December 11 2009 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
If you have any suggestions about the formulation of this compound for a direct oral gavage administration?
Antwort:
It can be dissolved in 30% PEG400/0.5% Tween80/5% Propylene glycol at 30 mg/ml as a suspension.
