nur für Forschungszwecke
Cediranib Maleate VEGFR Inhibitor
Kat.-Nr.S5242
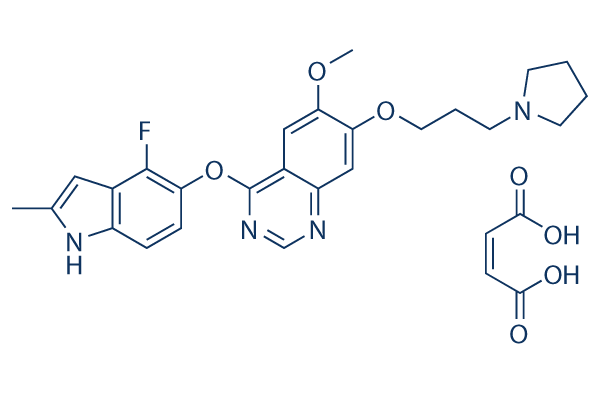
Chemische Struktur
Molekulargewicht: 566.58
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | EGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere VEGFR Inhibitoren | SAR131675 SU 5402 Cediranib (AZD2171) Vatalanib (PTK787) 2HCl Anlotinib (AL3818) Dihydrochloride Linifanib (ABT-869) Apatinib (YN968D1) Apatinib (YN968D1) mesylate Ki8751 ZM 323881 HCl |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 566.58 | Formel | C25H27FN4O3.C4H4O4 |
Lagerung (Ab dem Eingangsdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-Nr. | 857036-77-2 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | AZD2171 maleate | Smiles | CC1=CC2=C(N1)C=CC(=C2F)OC3=NC=NC4=CC(=C(C=C43)OC)OCCCN5CCCC5.C(=CC(=O)O)C(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(176.49 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
VEGFR2/KDR
(HUVECs) 0.5 nM
c-Kit
(HUVECs) 2 nM
c-Kit
(HUVECs) 2 nM
VEGFR3/FLT4
(HUVECs) <=3 nM
VEGFR1/FLT1
(HUVECs) 5 nM
PDGFRβ
(HUVECs) 5 nM
FGFR1
(HUVECs) 26 nM
FGFR1
(HUVECs) 26 nM
PDGFRα
(HUVECs) 36 nM
|
|---|---|
| In vitro |
In rekombinanten Kinase-Assays hemmt Cediranib die VEGFR-1-Kinaseaktivität (IC50 = 5 nmol/L) in einem ähnlichen Konzentrationsbereich wie VEGFR-2 und VEGFR-3 (IC50-Werte von <0,1 und ≤3 nmol/L). Es zeigt Selektivität gegenüber anderen Kinasen. Cediranib hat eine ähnliche Potenz gegen c-Kit im Vergleich zu VEGFR-2 in Phosphorylierungs-Assays, aber eine geringere Potenz gegen PDGFR-α und PDGFR-β, insbesondere in einem PDGF-AA/PDGFR-α-gesteuerten Tumorzellproliferationstest. Cediranib ist inaktiv gegen Wildtyp Flt-3 (IC50-Wert >1 µmol/L) und hatte eine geringe Aktivität gegenüber FGFR-1 und -4 (IC50-Werte von 0,35 bzw. 2,17 µmol/L). |
| In vivo |
Die Phosphorylierung von Wildtyp-c-Kit in NCI-H526-Tumorxenografts wurde nach oraler Verabreichung von Cediranib (≥1,5 mg/kg/Tag) an Tumortragende Nacktmäuse deutlich reduziert. |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00458731 | Completed | Adult Grade III Lymphomatoid Granulomatosis|Adult Nasal Type Extranodal NK/T-cell Lymphoma|Anaplastic Large Cell Lymphoma|Angioimmunoblastic T-cell Lymphoma|Childhood Burkitt Lymphoma|Childhood Diffuse Large Cell Lymphoma|Childhood Grade III Lymphomatoid Granulomatosis|Childhood Immunoblastic Large Cell Lymphoma|Childhood Nasal Type Extranodal NK/T-cell Lymphoma|Cutaneous B-cell Non-Hodgkin Lymphoma|Extranodal Marginal Zone B-cell Lymphoma of Mucosa-associated Lymphoid Tissue|Hepatosplenic T-cell Lymphoma|Intraocular Lymphoma|Nodal Marginal Zone B-cell Lymphoma|Noncutaneous Extranodal Lymphoma|Peripheral T-cell Lymphoma|Progressive Hairy Cell Leukemia Initial Treatment|Recurrent Adult Burkitt Lymphoma|Recurrent Adult Diffuse Large Cell Lymphoma|Recurrent Adult Diffuse Mixed Cell Lymphoma|Recurrent Adult Diffuse Small Cleaved Cell Lymphoma|Recurrent Adult Hodgkin Lymphoma|Recurrent Adult Immunoblastic Large Cell Lymphoma|Recurrent Adult Lymphoblastic Lymphoma|Recurrent Adult T-cell Leukemia/Lymphoma|Recurrent Childhood Anaplastic Large Cell Lymphoma|Recurrent Childhood Large Cell Lymphoma|Recurrent Childhood Lymphoblastic Lymphoma|Recurrent Childhood Small Noncleaved Cell Lymphoma|Recurrent Grade 1 Follicular Lymphoma|Recurrent Grade 2 Follicular Lymphoma|Recurrent Grade 3 Follicular Lymphoma|Recurrent Mantle Cell Lymphoma|Recurrent Mycosis Fungoides/Sezary Syndrome|Recurrent/Refractory Childhood Hodgkin Lymphoma|Refractory Hairy Cell Leukemia|Small Intestine Lymphoma|Splenic Marginal Zone Lymphoma|Stage IV Adult Burkitt Lymphoma|Stage IV Adult Diffuse Large Cell Lymphoma|Stage IV Adult Diffuse Mixed Cell Lymphoma|Stage IV Adult Diffuse Small Cleaved Cell Lymphoma|Stage IV Adult Hodgkin Lymphoma|Stage IV Adult Immunoblastic Large Cell Lymphoma|Stage IV Adult Lymphoblastic Lymphoma|Stage IV Adult T-cell Leukemia/Lymphoma|Stage IV Childhood Anaplastic Large Cell Lymphoma|Stage IV Childhood Hodgkin Lymphoma|Stage IV Childhood Large Cell Lymphoma|Stage IV Childhood Lymphoblastic Lymphoma|Stage IV Childhood Small Noncleaved Cell Lymphoma|Stage IV Grade 1 Follicular Lymphoma|Stage IV Grade 2 Follicular Lymphoma|Stage IV Grade 3 Follicular Lymphoma|Stage IV Mantle Cell Lymphoma|Stage IVA Mycosis Fungoides/Sezary Syndrome|Stage IVB Mycosis Fungoides/Sezary Syndrome|T-cell Large Granular Lymphocyte Leukemia|Testicular Lymphoma|Unspecified Adult Solid Tumor Protocol Specific|Unspecified Childhood Solid Tumor Protocol Specific|Waldenström Macroglobulinemia |
National Cancer Institute (NCI) |
May 2007 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
