nur für Forschungszwecke
Clofibric Acid PPAR Agonist
Kat.-Nr.S4207
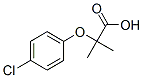
Chemische Struktur
Molekulargewicht: 214.65
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase Vitamin Carbohydrate Metabolism Mitochondrial Metabolism Drug Metabolite |
|---|---|
| Weitere PPAR Inhibitoren | T0070907 GW9662 GW6471 WY-14643 (Pirinixic Acid) GSK3787 GW0742 AZ6102 Harmine Astaxanthin Eupatilin |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 214.65 | Formel | C10H11ClO3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 882-09-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Chlorofibrinic acid | Smiles | CC(C)(C(=O)O)OC1=CC=C(C=C1)Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 43 mg/mL
(200.32 mM)
Ethanol : 43 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PPARα
|
|---|---|
| In vitro |
Clofibric Acid erhöht die Genexpression von CYP4A6 in RK13-Zellen, die mit PPAR-G transfiziert sind, mit einer EC50 von 80 μM. Die Behandlung mit Clofibric Acid (1 mM) über 4 Tage induziert eine 500-fache Erhöhung der P450 4Al-RNA und eine 280-fache Erhöhung der Acyl-CoA-Oxidase und P450 2Bl-RNA in Hepatozyten, relativ zu Kontrollkulturen. Clofibric Acid (250 μM) induziert eine Hochregulierung von Genen, die an der Peroxisomenproliferation und der Zellproliferation beteiligt sind, sowie eine Herunterregulierung von Genen, die an der Apoptose in Hepatozyten von Nagetieren beteiligt sind. Die Behandlung mit Clofibric Acid kann eine Hochregulierung des L-Fettsäure-bindenden Proteins (L-FABP)-Gens in Hepatozyten sowohl von Nagetier- als auch von menschlichem Ursprung verursachen. Clofibric Acid reguliert auch die Genexpression der zytosolischen, mikrosomalen und mitochondrialen Wege, die am Fettsäuretransport und Metabolism beteiligt sind, in sowohl Nagetier- als auch menschlichen Hepatozytenkulturen hoch und erhöht den Genspiegel des peroxisomalen Wegs des Lipid Metabolism bei Nagetieren. Eine Hochregulierung des Hepatozyten-Nuklearfaktors 1α (HNF 1α) durch Clofibric Acid wird in menschlichen Hepatozytenkulturen beobachtet. Clofibric Acid hemmt auch dosisabhängig die Zellproliferation von kultivierten OVCAR-3- und DISS-Zellen, die aus menschlichem Eierstockkrebs stammen. Die Behandlung mit Clofibric Acid erhöht die Expression der Carbonylreduktase, die die Umwandlung von Prostaglandin E2 (PGE2) in PGF 2α fördert. |
| In vivo |
Die Behandlung mit Clofibric Acid (50 mg/kg) über 4 Tage mittels Magensonde induziert sowohl die P450 4A- als auch die BFB-Expression in den Zonen 3 und 2 des Leberazinus bei Ratten. 300 mg/kg Clofibric Acid verursachen eine starke Färbung beider Proteine im gesamten Leberazinus. Die Behandlung mit Clofibric Acid (9.000 ppm) in der Nahrung unterdrückt das Wachstum von OVCAR-3-Tumoren, die s.c. xenotransplantiert wurden (46%), signifikant und verlängert die Überlebenszeit von Mäusen mit malignen Aszites, die von DISS-Zellen stammen, im Vergleich zur Kontrolle signifikant. Die Behandlung mit Clofibric Acid erhöht die Expression der Carbonylreduktase in vivo. Die Behandlung mit Clofibric Acid verringert den PGE2-Spiegel sowie die Menge an vaskulärem endothelialem Wachstumsfaktor (VEGF) sowohl in OVCAR-3-Tumoren als auch in DISS-abgeleiteten Aszites. Eine reduzierte Mikrovaskulardichte und induzierte Apoptose werden in soliden OVCAR-3-Tumoren beobachtet, die mit Clofibric Acid behandelt wurden. |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
