nur für Forschungszwecke
Golvatinib (E7050) c-Met Inhibitor
Kat.-Nr.S2859
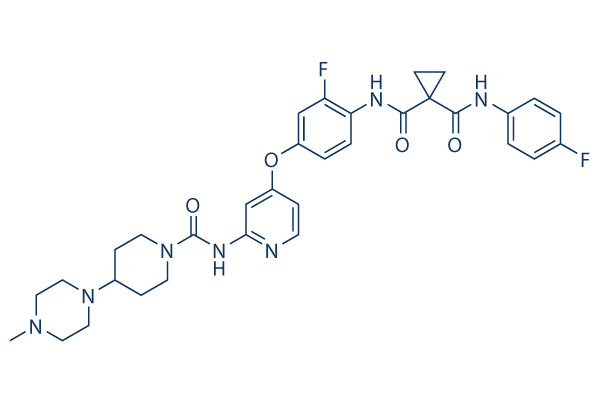
Chemische Struktur
Molekulargewicht: 633.69
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere c-Met Inhibitoren | Tepotinib Dihexa SGX-523 PHA-665752 Foretinib SU11274 BMS-777607 JNJ-38877605 Tivantinib PF-04217903 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 633.69 | Formel | C33H37F2N7O4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 928037-13-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CN1CCN(CC1)C2CCN(CC2)C(=O)NC3=NC=CC(=C3)OC4=CC(=C(C=C4)NC(=O)C5(CC5)C(=O)NC6=CC=C(C=C6)F)F | ||
Löslichkeit
|
In vitro |
DMSO
: 20 mg/mL
(31.56 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
c-Met
14 nM
VEGFR2
16 nM
|
|---|---|
| In vitro |
In-vitro-Studien zeigen, dass Golvatinib (E7050) die Phosphorylierung von sowohl c-Met als auch VEGFR-2 stark hemmt. Es unterdrückt auch stark das Wachstum von c-Met-amplifizierten Tumorzellen und Endothelzellen, die entweder mit HGF oder VEGF stimuliert wurden. Diese Verbindung umgeht die Resistenz gegen alle reversiblen, irreversiblen und mutationsselektiven EGFR-TKIs, die durch exogenes und/oder endogenes HGF in EGFR-mutierten Lungenkrebszelllinien induziert werden, indem sie den Met/Gab1/PI3K/Akt-Signalweg in vitro blockiert. Es verhindert auch das Auftreten von Gefitinib-resistenten HCC827-Zellen, die durch kontinuierliche Exposition gegenüber HGF induziert werden.
|
| Kinase-Assay |
Western-Blot-Analyse
|
|
Der Phosphorylierungsstatus von c-Met und VEGFR-2 wird mittels Western-Blot-Analyse nachgewiesen. Für c-Met werden MKN45-Zellen mit einer seriellen Verdünnung von Golvatinib (E7050) in komplettem Medium bei 37 °C für 2 h inkubiert. Für VEGFR-2 werden HUVEC 24 h lang in humanem endothelialem serumfreiem Medium mit 0,5 % FBS ausgehungert. Anschließend werden HUVEC 1 h lang mit einer seriellen Verdünnung dieser Verbindung inkubiert und danach 5 min lang mit 20 ng/mL humanem VEGF inkubiert. Die Zellen werden mit Lysepuffer (50 mM HEPES [pH 7,4], 150 mM NaCl, 10 % Glycerin, 1 % Triton X-100, 1,5 mM MgCl2, 1 mM EDTA [pH 8,0], 100 mM NaF, 1 mM Phenylmethylsulfonylfluorid, 1 mM Natriumorthovanadat, 10 μg/mL Aprotinin, 50 μg/mL Leupeptin und 1 μg/mL Pepstatin A) lysiert. Die resezierten Tumorproben werden mit Lysepuffer, der 25 mM β-Glycerophosphat und 0,5 % (v/v) Phosphataseinhibitor-Cocktail 2 enthält, bei 4 °C homogenisiert. Zellulärer Abfall wird durch Zentrifugation bei 17 860 g für 20 min bei 4 °C entfernt. Aliquots der Überstände, die 5-20 μg Protein enthalten, werden unter reduzierenden Bedingungen der SDS-PAGE unterzogen. Die Proteine werden dann auf PVDF-Membranen transferiert, die mit TBS, das 0,05 % Tween-20 und entweder 5 % Magermilch oder 5 % BSA enthält, blockiert werden. Die Membranen werden mit folgenden Antikörpern inkubiert: polyklonaler Anti-c-Met-Antikörper (C-28) und polyklonaler Anti-VEGFR-2-Antikörper (C-20); monoklonaler Anti-Phosphotyrosin-Antikörper Klon 4G10; und polyklonaler Anti-VEGFR-2-Antikörper, polyklonaler Anti-Phospho-VEGFR-2 (Tyr996)-Antikörper und polyklonaler Anti-Phospho-c-Met (Tyr1234/1235)-Antikörper. Der Nachweis erfolgt mit einem Super Signal Enhanced Chemiluminescence Kit. Immunoreaktive Banden werden durch Chemilumineszenz mit einem Image Master-VDS-CL-Detektionssystem visualisiert. Die Intensität jeder Bande wird mittels eines Bildanalysegeräts gemessen.
|
|
| In vivo |
Golvatinib (E7050) zeigt in vivo eine Hemmung der Phosphorylierung von c-Met und VEGFR-2 in Tumoren, mit einer starken Unterdrückung des Tumorwachstums und der Angiogenese in Xenograft-Modellen. Die Behandlung einiger Tumorlinien mit c-Met-Amplifikationen mit hohen Dosen dieser Verbindung (50–200 mg/kg) induziert Tumorrückbildung und -verschwinden. In einem Modell der peritonealen Dissemination zeigt es eine Antitumorwirkung gegen peritoneale Tumoren sowie eine signifikante Verlängerung der Lebensdauer bei behandelten Mäusen. In einer weiteren Xenograft-Studie sind Tumoren, die durch HGF-transfizierte Ma-1 (Ma-1/HGF)-Zellen erzeugt wurden, angiogener als Vektor-Kontrolltumoren und zeigen eine Resistenz gegen ZD1839. E7050 allein hemmt die Angiogenese und verzögert das Wachstum von Ma-1/HGF-Tumoren, und in Kombination mit ZD1839 induziert es eine ausgeprägte Regression des Tumorwachstums.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01355302 | Terminated | Advanced or Metastatic Solid Tumors|Previously Untreated Gastric Cancer |
Eisai Inc.|Quintiles Inc. |
November 2011 | Phase 1|Phase 2 |
| NCT01433991 | Terminated | Advanced Solid Tumors |
Eisai Inc. |
October 13 2011 | Phase 1|Phase 2 |
| NCT01332266 | Completed | Platinum-Resistant Squamous Cell Carcinoma of the Head and Neck |
Eisai Inc.|PharmaBio Development Inc. |
September 19 2011 | Phase 1|Phase 2 |
| NCT01271504 | Completed | Hepatocellular Carcinoma |
Eisai Inc.|PharmaBio Development Inc. |
July 19 2011 | Phase 1|Phase 2 |
| NCT02533102 | Completed | Healthy Subjects |
Eisai Limited|Eisai Inc. |
November 2010 | Phase 1 |
| NCT00921869 | Completed | Solid Tumors |
Eisai Co. Ltd.|Eisai Inc. |
October 2009 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
