nur für Forschungszwecke
Lucitanib (E3810) hydrochloride VEGFR Inhibitor
Kat.-Nr.S7647
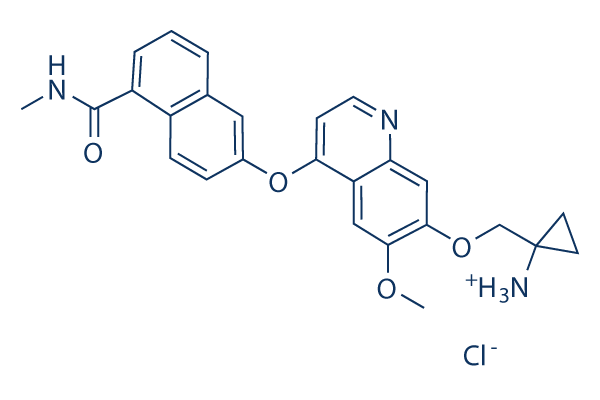
Chemische Struktur
Molekulargewicht: 479.96
Qualitätskontrolle
| Verwandte Ziele | EGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere VEGFR Inhibitoren | SAR131675 SU 5402 Cediranib (AZD2171) Vatalanib (PTK787) 2HCl Anlotinib (AL3818) Dihydrochloride Linifanib (ABT-869) Apatinib (YN968D1) Apatinib (YN968D1) mesylate Ki8751 ZM 323881 HCl |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 479.96 | Formel | C26H26ClN3O4 |
Lagerung (Ab dem Eingangsdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-Nr. | 1058137-23-7 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | AL3810 | Smiles | [Cl-].CNC(=O)C1=CC=CC2=C1C=CC(=C2)OC3=CC=NC4=CC(=C(OC)C=C34)OCC5([NH3+])CC5 | ||
Löslichkeit
|
In vitro |
DMSO
: 59 mg/mL
(122.92 mM)
Water : 59 mg/mL Ethanol : 30 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
VEGFR1
(Cell-free assay) 7 nM
VEGFR3
(Cell-free assay) 10 nM
FGFR1
(Cell-free assay) 17.5 nM
VEGFR2
(Cell-free assay) 25 nM
FGFR2
(Cell-free assay) 82.5 nM
|
|---|---|
| In vitro |
In vitro hemmt Lucitanib (E3810) die VEGF- und bFGF-abhängige Proliferation und die durch VEGF- und bFGF-Ligandenbindung an ihre kognaten Rezeptoren in HUVEC-Zellen ausgelösten Signaltransduktionswege im nanomolaren Bereich. |
| In vivo |
In vivo hemmt eine 7-tägige Behandlung mit Lucitanib (E3810) die FGF-induzierte Angiogenese in einem implantierten Matrigel-Plug in Mäusen vollständig; die Lucitanib (E3810)-Behandlung reduziert die Tumorgefäßdichte in behandelten Tumoren (gemessen durch die Abnahme der CD31-Färbung signifikant), erhöht den Prozentsatz der Tumornekrose und verändert die Zusammensetzung des Tumorstromas (mit einer Abnahme des Kollagen IV-Gehalts). |
Literatur |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT04042116 | Suspended | Advanced Solid Tumor|Gynecologic Cancer |
Clovis Oncology Inc.|Bristol-Myers Squibb|European Network of Gynaecological Oncological Trial Groups (ENGOT) |
July 29 2019 | Phase 1|Phase 2 |
| NCT02747797 | Withdrawn | Advanced Cancer |
Teresa Helsten MD|Clovis Oncology Inc.|University of California San Diego |
April 2017 | Phase 2 |
| NCT02202746 | Terminated | Breast Cancer|Metastatic Breast Cancer|MBC|HER2 Positive|HER2|Estrogen Receptor Positive|ER|Triple Negative |
Clovis Oncology Inc. |
September 9 2014 | Phase 2 |
| NCT02109016 | Terminated | Non-Small Cell Lung Cancer|Squamous Non-Small Cell Lung Cancer|NSCLC|Small Cell Lung Cancer|SCLC|Lung Cancer|Advanced Lung Cancer|Metastatic Lung Cancer|Stage IV Lung Cancer |
Clovis Oncology Inc. |
April 2014 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
