nur für Forschungszwecke
MK-2461 c-Met Inhibitor
Kat.-Nr.S2774
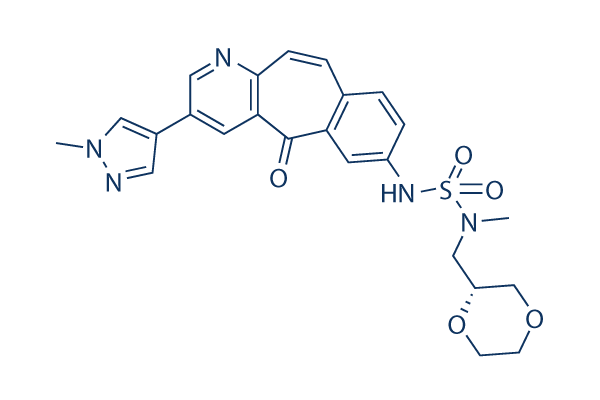
Chemische Struktur
Molekulargewicht: 495.55
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere c-Met Inhibitoren | Tepotinib Dihexa SGX-523 PHA-665752 Foretinib SU11274 BMS-777607 JNJ-38877605 Tivantinib PF-04217903 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 495.55 | Formel | C24H25N5O5S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 917879-39-1 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CN1C=C(C=N1)C2=CC3=C(C=CC4=C(C3=O)C=C(C=C4)NS(=O)(=O)N(C)CC5COCCO5)N=C2 | ||
Löslichkeit
|
In vitro |
DMSO
: 99 mg/mL
(199.77 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Preferentially binds to activated c-Met, distinguished from other known ATP-competitive tyrosine kinase inhibitors (which bind to inactive and active kinases with similar affinity).
|
|---|---|
| Targets/IC50/Ki |
c-Met (M1250T)
0.4 nM
c-Met (Y1235D)
0.5 nM
c-Met (Y1230H)
1.0 nM
c-Met (N1100)
1.5 nM
c-Met (Y1230C)
1.5 nM
c-Met
2.5 nM
RON
7 nM
FLT1
10 nM
FLT3
22 nM
PDGFRβ
22 nM
Mer
24 nM
FGFR2
39 nM
KDR
44 nM
TrkA
46 nM
FGFR3
50 nM
TrkB
61 nM
FGFR1
65 nM
FLT4
78 nM
DRAK1
199 nM
JAK2
225 nM
|
| In vitro |
MK-2461 hemmt auch potent FGFR1, FGFR2, FGFR3, KDR, TrkA, TrkB und Flt4 mit einer IC50 von 65 nM, 39 nM, 50 nM, 44 nM, 46 nM, 61 nM bzw. 78 nM. Im Vergleich zu Wildtyp-c-Met hemmt diese Verbindung die Aktivität onkogener c-Met-Kinase-Mutanten wie N1100Y, Y1230C, Y1230H, Y1235D und M1250T potenter mit einer IC50 von 1,5 nM, 1,5 nM, 1,0 nM, 0,5 nM bzw. 0,4 nM. Es bindet stärker an phosphoryliertes c-Met als an unphosphoryliertes c-Met. Diese Chemikalie hemmt potent die ATP-induzierte Autophosphorylierung der COOH-terminalen Docking-Domäne von c-Met, aber nicht die Aktivierungsschleife. Im Gegensatz dazu hemmt es die Phosphorylierung der Aktivierungsschleife von FGFR2 (Y653/Y654) in Kato III-Zellen und PDGFRα (Y844) in H1703-Zellen mit einer IC50 von <0,3 μM. Es hemmt die HGF-induzierte Mitogenese von 4MBr-5-Zellen mit einer IC50 von 204 nM und die HGF-induzierte Migration von HPAF II-Zellen mit einer IC50 von 404 nM sowie die HGF-induzierte verzweigte Tubulogenese von MDCK-Zellen. Darüber hinaus hemmt diese Verbindung potent die IL-3-unabhängige Proliferation von 32D-Zellen, die mit Tpr-Met oder Tpr-Met (Y362C)-Mutanten transformiert wurden, mit einer IC50 von ~100 nM. Es hemmt signifikant die Proliferation einer großen Reihe von Tumorzelllinien, insbesondere potent gegen Tumorzellen, die eine genomische Amplifikation von MET oder FGFR2 aufweisen.
|
| Kinase-Assay |
Zeitaufgelöster Fluoreszenz-Resonanzenergietransfer-Assay
|
|
Die c-Met-katalysierte Phosphorylierung von N-biotinyliertem Peptid (EQEDEPEGDYFEWLE-CONH2) wird mittels eines zeitaufgelösten Fluoreszenz-Resonanzenergietransfer-Assays gemessen. Die IC50 dieser Verbindung für Ron, Mer, Flt1, Flt3, Flt4, KDR, PDGFRβ, FGFR1, FGFR2, FGFR3, TrkA und TrkB werden mittels zeitaufgelöster Fluoreszenz-Resonanzenergietransfer-Assays bestimmt, die dem c-Met-Kinase-Assay ähneln.
|
|
| In vivo |
Die Behandlung mit MK-2461 hemmt signifikant die c-Met (Y1349)-Phosphorylierung in GTL-16-Tumoren mit einer IC50 von ~1 μM. Die orale Verabreichung dieser Verbindung mit 10 mg/kg, 50 mg/kg und 100 mg/kg zweimal täglich sowie 200 mg/kg einmal täglich unterdrückt effektiv das Tumorwachstum von GTL-16-Xenotransplantaten in Mäusen um 62%, 77%, 75% bzw. 90%. Ähnlich hemmt diese chemische Behandlung mit 134 mg/kg zweimal täglich das Wachstum von NIH3T3-Tumoren, die c-Met-Einzelnukleotidmutanten T3936C und T3997C aufweisen, um 78% bzw. 62%.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00496353 | Completed | Neoplasm |
Merck Sharp & Dohme LLC |
June 2007 | Phase 1|Phase 2 |
| NCT00518739 | Completed | Advanced Cancer |
Merck Sharp & Dohme LLC |
February 2007 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
