nur für Forschungszwecke
TAE226 (NVP-TAE226) FAK Inhibitor
Kat.-Nr.S2820
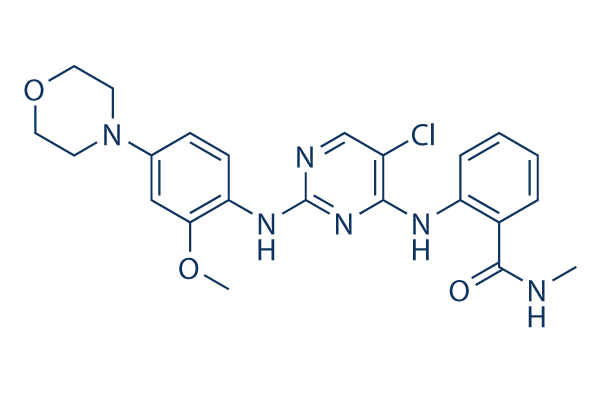
Chemische Struktur
Molekulargewicht: 468.94
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT FLT3 HER2 |
|---|---|
| Weitere FAK Inhibitoren | Defactinib (VS-6063) PF-562271 (VS-6062) PF-573228 VS-4718 (PND-1186) PF-562271 HCl PF-562271 Besylate GSK2256098 PF-431396 Y15 Solanesol (Nonaisoprenol) |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| HCT116 cells | Proliferation assay | 48 h | Antiproliferative activity against human HCT116 cells after 48 hrs by WST-1 assay, IC50=0.4 μM | |||
| HUVEC | Function assay | 72 h | Antiangiogenic activity in HUVEC assessed as inhibition of VEGF-stimulated proliferation after 72 hrs by WST-1 assay, IC50=1 μM | |||
| U87MG cells | Proliferation assay | 48 h | Antiproliferative activity against human U87MG cells after 48 hrs by WST-1 assay, IC50=1.2 μM | |||
| PC3 cells | Proliferation assay | 48 h | Antiproliferative activity against human PC3 cells after 48 hrs by WST-1 assay, IC50=1.6 μM | |||
| MDA-MB-231 cells | Proliferation assay | 48 h | Antiproliferative activity against human MDA-MB-231 cells after 48 hrs by WST-1 assay, IC50=2.8 μM | |||
| BT474 cells | Function assay | 1 μM | 24 h | Induction of apoptosis in human BT474 cells assessed as cleavage of 89 kDa PARP at 1 uM after 24 hrs by Western blotting | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 468.94 | Formel | C23H25ClN6O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 761437-28-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CNC(=O)C1=CC=CC=C1NC2=NC(=NC=C2Cl)NC3=C(C=C(C=C3)N4CCOCC4)OC | ||
Löslichkeit
|
In vitro |
DMSO
: 94 mg/mL
(200.45 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PYK2
(cell-free assay) 3.5 nM
FAK
(cell-free assay) 5.5 nM
Insulin Receptor
(cell-free assay) 43.5 nM
IGF-1R
(cell-free assay) 140 nM
c-Met
(cell-free assay) 160 nM
FLT4
(cell-free assay) 220 nM
FLT1
(cell-free assay) 3.4 μM
|
|---|---|
| In vitro |
TAE226 (NVP-TAE226) (< 1 μM) hemmt die extrazelluläre Matrix-induzierte Autophosphorylierung von FAK (Tyr397) in serumstarvierten U87-Zellen. Diese Verbindung (< 1 μM) hemmt auch die IGF-I-induzierte Phosphorylierung von IGF-1R und die Aktivität seiner nachgeschalteten Zielgene wie MAPK und Akt in U87- und U251-Zellen. Diese Chemikalie (<10 μM) verzögert das Wachstum von Tumorzellen und schwächt die G(2)-M-Zellzyklusprogression ab, die mit einer Abnahme der Cyclin B1- und phosphorylierten cdc2 (Tyr15)-Proteinexpression in U87- und U251-Zellen verbunden ist. Diese Verbindung (1 μM) hemmt die Tumorzellinvasion um mindestens 50 % im Vergleich zur Kontrolle in einem In-vitro-Matrigel-Invasionstest in Gliomzelllinien. Diese Chemikalie (1 μM) Behandlung von Gliomzelllinien, die Wildtyp-p53 enthalten, zeigt hauptsächlich einen G(2)-M-Arrest, während Gliomzelllinien, die mutiertes p53 tragen, Apoptose durchlaufen, wie durch den Nachweis von Caspase-3/7-Aktivierung und Poly(ADP-Ribose)-Polymerase-Spaltung und durch einen Annexin V Apoptosis Assay belegt wird. Diese Verbindung (5 μM) hemmt die Phosphorylierung von FAK in der menschlichen Neuroblastomzelllinie SK-N-AS. Diese Chemikalie (<10 μM) Behandlung der menschlichen Neuroblastomzelllinie SK-N-AS führt zu einer Abnahme der zellulären Viabilität, einem Zellzyklusarrest und einer Zunahme der Apoptose. Diese Verbindung (0,1 μM-10 μM) hemmt die Röhrenbildung von HMEC1-Zellen.
|
| In vivo |
TAE226 (NVP-TAE226) (75 mg/kg) erhöht die Überlebensrate von Mäusen mit intrakraniellen Gliom-Xenotransplantaten signifikant. Diese Verbindung (100 mg/kg, oral) bewirkt eine signifikante Abnahme der Mikrovaskulardichte in einem menschlichen Kolonkrebsmodell in SCID-Mäusen. Diese Chemikalie (100 mg/kg, oral) hemmt effizient das Wachstum von MIA PaCa-2 humanen Pankreastumoren ohne Gewichtsverlust im In-vivo-Modell. Es hemmt das Wachstum von 4T1 murinen Brusttumoren und die Metastasierung in die Lunge dosisabhängig im In-vivo-Modell, verbunden mit der Hemmung der FAK-Autophosphorylierung an Y397 und der Akt-Phosphorylierung an Serine473.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Growth inhibition assay | Cell viability |
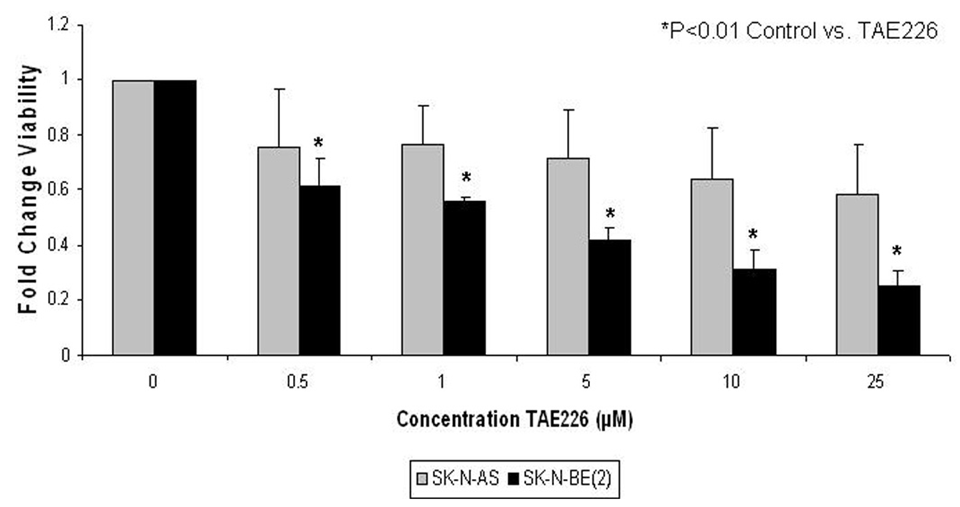
|
21196322 |
| Western blot | FAK / p-FAK(Y397) / p-AKT(S473) / AKT / pERK / ERK |
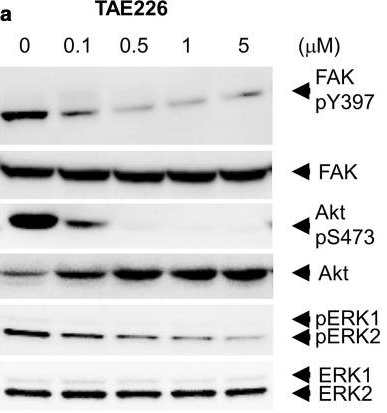
|
31215459 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
