nur für Forschungszwecke
Tubastatin A HCl HDAC Inhibitor
Kat.-Nr.S2627
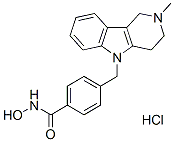
Chemische Struktur
Molekulargewicht: 371.86
Qualitätskontrolle
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| neuron cultures | Kinase assay | 2.5 μM | DMSO | induces α-tubulin hyperacetylation | ||
| neuron cultures | Function assay | ~10 μM | DMSO | protects against glutathione depletion-induced oxidative stress | ||
| 134/04 | Function assay | 7.5 µM | impairs myotube formation | |||
| C2C12 | Function assay | 7.5 µM | impairs myotube formation | |||
| HaCaT keratinocytes | Function assay | 10 μM | blocks arsenite from inducing Nrf2 protein translation | |||
| JURL-MK1 | Function assay | 10 μM | enhances cell adhesivity to fibronectin | |||
| CML-T1 | Function assay | 10 μM | enhances cell adhesivity to fibronectin | |||
| K562 | Function assay | 10 μM | enhances cell adhesivity to fibronectin | |||
| HL-60 | Function assay | 10 μM | enhances cell adhesivity to fibronectin | |||
| KMCH | Growth inhibitory assay | ~10 μM | decreases proliferation and anchorage-independent growth | |||
| THP-1 | Function assay | ~10 μM | inhibits TNF-α and IL-6 secretion | |||
| RAW 264.7 | Function assay | ~10 μM | attenuates NO production | |||
| HT3 | Function assay | ~5 μM | DMSO | induces the differential α-tubulin acetylation | ||
| SiHa | Function assay | ~5 μM | DMSO | induces the differential α-tubulin acetylation | ||
| CaSki | Function assay | ~5 μM | DMSO | induces the differential α-tubulin acetylation | ||
| SiHa | Function assay | ~5 μM | DMSO | inhibits Thapsigargin- or EGF-induced SOCE activation | ||
| CaSki | Function assay | ~5 μM | DMSO | inhibits Thapsigargin- or EGF-induced SOCE activation | ||
| MCF-7 | Growth inhibitory assay | 30 μM | DMSO | IC50=15 μM | ||
| MCF-7 | Function assay | 30 μM | DMSO | increases the microtubule acetylation level. | ||
| MCF-7 | Function assay | 30 μM | DMSO | stabilizes microtubules against cold-induced depolymerization | ||
| MCF-7 | Function assay | 15 μM | DMSO | stabilizes microtubules against nocodazole-induced disassembly | ||
| MCF-7 | Function assay | 30 μM | DMSO | alteres the assembly dynamics of interphase microtubules | ||
| MCF-7 | Function assay | 30 μM | DMSO | increases the binding of HDAC6 with interphase microtubules | ||
| PC12 | Function assay | ~3 μM | DMSO | up-regulates anti-oxidative gene expression related to transcription factor XBP1s | ||
| PC12 | Growth inhibitory assay | ~3 μM | DMSO | reverse H2O2-induced growth inhibition | ||
| HEK293T | Function assay | ~3 μM | DMSO | up-regulated XBP1s protein level | ||
| HEK293T | Function assay | ~3 μM | DMSO | delays XBP1s protein degradation via acetylation-mediated proteasomal degradation | ||
| Huh7 | Function assay | ~5 μM | DMSO | suppresses proliferation of hepatitis C virus replicon with EC50 = 0.3 μM | ||
| SKMEL21 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| SKMEL103 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| SKMEL28 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM164 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM1361a | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM1366 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM793 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM35 | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM983a | Growth inhibitory assay | ~500 nM | DMSO | inhibits cell proliferation | ||
| WM793 | Function assay | ~6 μM | DMSO | induce G1 arrest | ||
| WM164 | Function assay | ~6 μM | DMSO | induce G1 arrest | ||
| WM983a | Function assay | ~6 μM | DMSO | induce G1 arrest | ||
| WM164 | Function assay | ~3 μM | DMSO | augments expression of MHC class I and melanoma associated antigens | ||
| WM983a | Function assay | ~3 μM | DMSO | augments expression of MHC class I and melanoma associated antigens | ||
| IPC298 | Function assay | ~3 μM | DMSO | augments expression of MHC class I and melanoma associated antigens | ||
| SKMEL30 | Function assay | ~3 μM | DMSO | augments expression of MHC class I and melanoma associated antigens | ||
| TCa83 | Function assay | induces PTEN expression and membrane translocation | ||||
| 293T | Function assay | ~2 μg/ml | induces PTEN expression and membrane translocation | |||
| SACC-83 | Function assay | ~2 μg/ml | induces PTEN expression and membrane translocation | |||
| 293T | Function assay | ~2 μg/ml | induces PTEN acetylation at K163 | |||
| U-87 MG | Function assay | ~2 μg/ml | inhibits the migration and invasion | |||
| U-87 MG | Function assay | ~10 μM | inhibits AKT phosphorylation | |||
| U-87 MG | Growth inhibitory assay | ~10 μM | inhibits cell growth | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 371.86 | Formel | C20H21N3O2.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1310693-92-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(268.91 mM)
Mit 50°C Wasserbad erwärmt;
Ultraschallbehandelt;
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
HDAC6
(Cell-free assay) 15 nM
HDAC8
(Cell-free assay) 854 nM
|
|---|---|
| In vitro |
Tubastatin A ist im Wesentlichen selektiv für alle 11 HDAC-Isoformen und behält eine über 1000-fache Selektivität gegenüber allen Isoformen, außer HDAC8, wo es eine etwa 57-fache Selektivität aufweist. In Homocysteinsäure (HCA)-induzierten Neurodegenerationsassays zeigt Tubastatin A einen dosisabhängigen Schutz gegen HCA-induzierten neuronalen Zelltod ab 5 μM mit nahezu vollständigem Schutz bei 10 μM. Bei 100 ng/mL Tubastatin A erhöht sich die Suppression der T-Zell-Proliferation in vitro durch Foxp3+ T-regulatorische Zellen (Tregs). Die Behandlung von C2C12-Zellen mit Tubastatin A würde zu einer Beeinträchtigung der Myotubenbildung führen, wenn Alpha-Tubulin früh im myogenen Prozess hyperacetyliert ist; die Myotubenverlängerung tritt jedoch auf, wenn Alpha-Tubulin in Myotuben hyperacetyliert ist. Eine aktuelle Studie zeigt, dass die Behandlung mit Tubastatin A die Zellplastizität erhöht, wie durch Atomkraftmikroskopie (AFM)-Tests gezeigt, ohne drastische Veränderungen an den Aktin-Mikrofilament- oder Mikrotubulusnetzwerken in Maus-Ovarialkarzinomzelllinien, MOSE-E und MOSE-L, hervorzurufen.
|
| Kinase-Assay |
Enzymhemmungstests
|
|
Enzymhemmungstests werden von der Reaction Biology Corporation, Malvern, PA, unter Verwendung der Reaction Biology HDAC Spectrum Plattform durchgeführt. (www.reactionbiology.com) Die HDAC1-, 2-,4-, 5-, 6-, 7-, 8-, 9-, 10- und 11-Assays verwenden isoliertes rekombinantes menschliches Protein; für den HDAC3-Assay wird der HDAC3/NcoR2-Komplex verwendet. Das Substrat für die HDAC1-, 2-, 3-, 6-, 10- und 11-Assays ist ein fluorogenes Peptid aus p53-Resten 379-382 (RHKKAc); das Substrat für HDAC8 ist ein fluorogenes Diacylpeptid, das auf den Resten 379-382 von p53 (RHKAcKAc) basiert. Acetyl-Lys (Trifluoracetyl)-AMC-Substrat wird für die HDAC4-, 5-, 7- und 9-Assays verwendet. Tubastatin A wird in DMSO gelöst und im 10-Dosis-IC50-Modus mit einer 3-fachen Reihenverdünnung ab 30 μM getestet. Die Kontrollsubstanz Trichostatin A (TSA) wird in einem 10-Dosis-IC50-Modus mit einer 3-fachen Reihenverdünnung ab 5 μM getestet. IC50-Werte werden durch Kurvenanpassung der Dosis-Wirkungs-Kurven extrahiert.
|
|
| In vivo |
Die tägliche Behandlung mit Tubastatin A bei 0,5 mg/kg hemmt HDAC6, um die suppressive Aktivität von Tregs in Mausmodellen für Entzündungen und Autoimmunität zu fördern, einschließlich mehrerer Formen experimenteller Kolitis und vollständig Major Histocompatibility Complex (MHC)-inkompatibler Herzallograft-Abstoßung.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
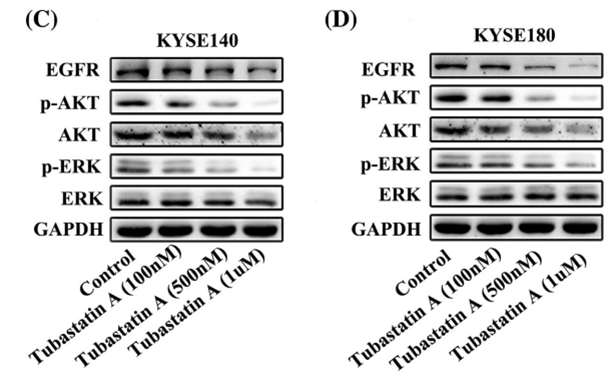
| Western blot | EGFR / p-AKT / AKT / p-ERK / ERK |
|
29665050 |
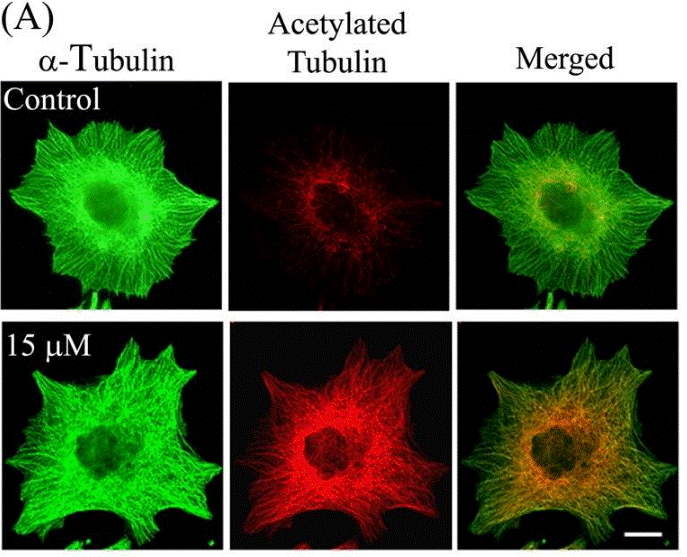
| Immunofluorescence | α-tubulin / Acetylated tubulin HDAC6 |
|
23798680 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
