nur für Forschungszwecke
Bezafibrate PPAR Agonist
Kat.-Nr.S4159
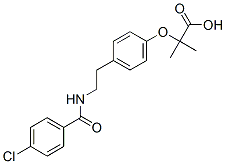
Chemische Struktur
Molekulargewicht: 361.82
Qualitätskontrolle
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase Vitamin Carbohydrate Metabolism Mitochondrial Metabolism Drug Metabolite |
|---|---|
| Weitere PPAR Inhibitoren | T0070907 GW9662 GW6471 WY-14643 (Pirinixic Acid) GSK3787 GW0742 AZ6102 Harmine Astaxanthin Eupatilin |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 361.82 | Formel | C19H20ClNO4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 41859-67-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | BM 15075 | Smiles | CC(C)(C(=O)O)OC1=CC=C(C=C1)CCNC(=O)C2=CC=C(C=C2)Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 72 mg/mL
(198.99 mM)
Ethanol : 60 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PPAR
|
|---|---|
| In vitro |
Bezafibrate ist ein lipidsenkendes Fibrinsäurederivat. Diese Verbindung bindet an xPPARβ mit einer EC50 von 5 μM. Sie aktiviert transkriptionell die PPARβ von Xenopus mit einer EC50 von 1 μM. Dieses chemische Expositionsmittel für die Primärkultur von Adipozyten der Ratte erhöht über 24 Stunden die mRNA-Spiegel wichtiger Gene, die an der peroxisomalen und mitochondrialen β-Oxidation beteiligt sind. Die mRNA-Spiegel der peroxisomalen β-Oxidations-geschwindigkeitsbestimmenden Enzym-Acyl-CoA-Oxidase und der muskeltypischen Carnitin-Palmitoyl-Transferase I (M-CPT-I) steigen jeweils um das 1,6-Fache und das 4,5-Fache. Es induziert einen Anstieg der Transkriptspiegel des Entkopplungsproteins-2 (UCP-2; 1,5-fache Induktion) und UCP-3 (3,7-fache Induktion), mitochondrialer Proteine, die die ATP-Ausbeute reduzieren und die Oxidation von Fettsäuren erleichtern können. Ferner erhöht diese Verbindung die mRNA-Spiegel der Fettsäuretranslokase (2-fache Induktion). Sie verursacht eine 1,9-fache Induktion der 9,10-[3H]Palmitat-Oxidation. Darüber hinaus reduziert diese Chemikalie die mRNA-Expression mehrerer Adipozyten-Marker, einschließlich PPARγ (30 % Reduktion), Tumornekrosefaktor-α (33 % Reduktion) und des ob-Gens (26 % Reduktion). Die durch sie verursachte Reduktion der Adipozyten-Marker wird von einem Anstieg der mRNA-Spiegel des Präadipozyten-Markers Pref-1 (1,6-fache Induktion) begleitet.
|
| In vivo |
Die Bezafibrate-Behandlung ist in der Lage, die mRNA-Spiegel von M-CPT-I (4,5-fache Induktion), Fettsäuretranslokase (2,6-fache Induktion) und Pref-1 (5,6-fache Induktion) im epididymalen weißen Fettgewebe von Ratten zu erhöhen. Ähnlich steigt sie an. Die Verabreichung dieser Verbindung führt zu einem signifikanten Anstieg des Lebergewichts bei Wildtyp- und PPARβ-null-Mäusen im Vergleich zu Kontrollen, während das Lebergewicht bei ähnlich gefütterten PPARα-null-Mäusen unverändert bleibt. Die gonadalen Fettreserven sind bei Wildtyp- und PPARβ-null-Mäusen, die diese Verbindung erhielten, signifikant kleiner als bei Kontrollen (2,8-fach weniger bzw. ~2,6-fach weniger), und dieser Effekt wurde bei ähnlich gefütterten PPARα-null-Mäusen nicht gefunden. Es ist in der Lage, Änderungen der mRNAs von Lipidstoffwechselenzymen (wie AOX, Cytochrom P450 4A (CYP4A), LPL, ACS und LCA D) bei Wildtyp-, PPARβ-null-Mäusen und PPARα-null-Mäusen im Vergleich zu Kontrollen zu verursachen. Diese Chemikalie ist in der Lage, die UCPs-Expression zu induzieren und die Energiehomöostase durch direkte Induktion der aco-Genexpression (14,5-fach nach 7 Tagen) und der peroxisomalen Fettsäure-β-Oxidation im weißen Fettgewebe von Ratten zu modifizieren. Ferner reduziert sie signifikant die Plasma-Triglycerid- und Leptinkonzentrationen, ohne die Spiegel von PPARγ oder des ob-Gens im weißen Fettgewebe zu modifizieren.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02291796 | Completed | Acute Myocardial Infarction |
Instituto Mexicano del Seguro Social |
January 2011 | Phase 4 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
