nur für Forschungszwecke
Selisistat (EX-527) SIRT1 Inhibitor
Kat.-Nr.S1541
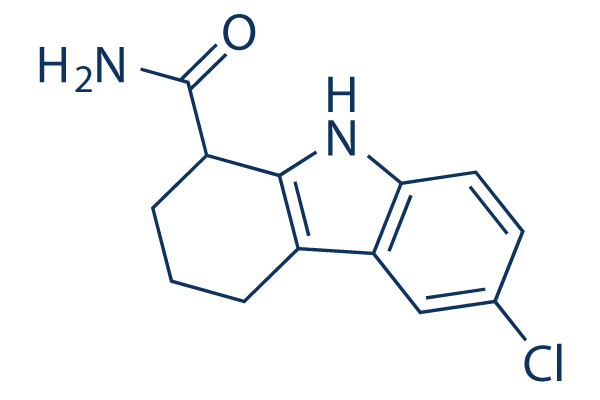
Chemische Struktur
Molekulargewicht: 248.71
Qualitätskontrolle
| Verwandte Ziele | HDAC JAK BET Histone Methyltransferase PKC PARP HIF PRMT EZH2 AMPK |
|---|---|
| Weitere Sirtuin Inhibitoren | SRT1720 HCl Sirtinol Fisetin 3-TYP AGK2 SRT2104 (GSK2245840) OSS_128167 SirReal2 Thiomyristoyl NRD167 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| Platelets | Apoptosis Assay | 10/50 μM | 10 min | DMSO | increases ROS level in a dose-dependent manner | 25829495 |
| HEK 293 | Growth Inhibition Assay | 24 h | IC50=97.7 ± 8.1 μM | 24998427 | ||
| HeLa | Growth Inhibition Assay | 24 h | IC50=37.9 ± 1.8 μM | 24998427 | ||
| HEK 293 | Growth Inhibition Assay | 48 h | IC50=69.0 ± 0.7 μM | 24998427 | ||
| HeLa | Growth Inhibition Assay | 48 h | IC50=8.9 ± 1.9 μM | 24998427 | ||
| RMECs | Apoptosis Assay | 10 μM | 24 h | attenuates the anti-apoptotic effect of Des-G | 24486147 | |
| HUVECs | Apoptosis Assay | 10 μM | 24 h | bolishes the protective effect of resveratrol in cell viability | 23358928 | |
| K562 | Function Assay | 0.1-1 μM | 2 h | stimulates Nrf2-dependent gene transcription | 21196497 | |
| INS-1E | Function Assay | 1 μm | 24 h | prevents resveratrol-induced up-regulation of Glut2, glucokinase,Pdx-1, and Tfam | 21163946 | |
| MCF-7 | Growth Inhibition Assay | 0-100 μM | 24/48/72 h | DMSO | represses cell proliferation at the concentration ≥100 μM | 20371709 |
| NCI-H460 | Function Assay | 1 μm | 6 h | DMSO | produces a concentration-dependent increase in the amount of acetylated p53 | 16354677 |
| 293T | Function assay | Inhibition of human recombinant GST-tagged SIRT1 expressed in 293T cells by Fluor de Lys fluorescence assay, IC50 = 0.038 μM. | 21306906 | |||
| Escherichia coli cells | Function assay | Inhibition of human recombinant SIRT1 expressed in Escherichia coli cells using acetylated Lys side chain amino acids 379-382 (Arg-His-Lys-Lys(Ac)) p53 conjugated with aminomethylcoumarin as substrate by fluorescence assay, IC50 = 0.16 μM. | 22931526 | |||
| BL21 (DE3) | Function assay | Inhibition of full length human SIRT1 expressed in Escherichia coli BL21 (DE3) cells using fluorogenic 7-amino-4-methylcoumarin (AMC)-labeled peptide by fluorescence assay, IC50 = 0.21 μM. | 25275824 | |||
| Namalwa cells | Function assay | 3 hrs | Inhibition of SIRT1-mediated endogenous p53 deacetylase activity in human Namalwa cells assessed as concentration required to enhance p53 deacetylation to twice the basal level after 3 hrs by ELISA, INH = 0.6 μM. | 25971769 | ||
| BL21 (DE3) | Function assay | Inhibition of full length human SIRT2 expressed in Escherichia coli BL21 (DE3) cells using fluorogenic 7-amino-4-methylcoumarin (AMC)-labeled peptide by fluorescence assay, IC50 = 1.94 μM. | 25275824 | |||
| Escherichia coli cells | Function assay | Inhibition of human recombinant SIRT2 expressed in Escherichia coli cells using acetylated Lys side chain amino acids 379-382 (Arg-His-Lys-Lys(Ac)) p53 conjugated with aminomethylcoumarin as substrate by fluorescence assay, IC50 = 48.5 μM. | 22931526 | |||
| A673 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for A673 cells | 29435139 | |||
| SK-N-MC | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-MC cells | 29435139 | |||
| Hs683 | Cell cycle assay | 24 to 48 hrs | Cell cycle arrest in human Hs683 cells assessed as accumulation at G1 phase at IC50 after 24 to 48 hrs by propidium iodide staining-based flow cytometry | 28475330 | ||
| HCT116 | Function assay | 10 uM | 8 hrs | Inhibition of SIRT1 in human HCT116 cells assessed as increase in acetylated p53 at 10 uM after 8 hrs by Western blot analysis | 22642300 | |
| NCI-H460 | Function assay | 6 hrs | Inhibition of SIRT-2 in human NCI-H460 cells assessed as inhibition of p53 deacetylation after 6 hrs by immunoprecipitation/immunoblotting analysis, IC50 = 1 μM. | ChEMBL | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 248.71 | Formel | C13H13ClN2O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 49843-98-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | SEN0014196 | Smiles | C1CC(C2=C(C1)C3=C(N2)C=CC(=C3)Cl)C(=O)N | ||
Löslichkeit
|
In vitro |
DMSO
: 300 mg/mL
(1206.22 mM)
Ethanol : 30 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Greater potency, specificity, stability, and lower toxicity than other inhibitors of SIRT1 catalytic activity identified to date.
|
|---|---|
| Targets/IC50/Ki |
SIRT1
(Cell-free assay) 38 nM
|
| In vitro |
Selisistat (EX 527) zeigt eine potente Hemmwirkung gegen die SIRT1-Deacetylase-Aktivität in einer konzentrationsabhängigen Weise mit einem IC50-Wert von 38 nM und zeigt eine viel geringere Aktivität gegen SIRT2 und SIRT3 mit IC50-Werten von 19,6 μM bzw. 48,7 μM. Es hemmt SIRT4-7 und die Aktivität der Klasse I/II HDAC nicht bei Konzentrationen bis zu 100 μM. Diese Verbindung allein (1 μM) hat keine nachweisbaren Auswirkungen auf die Acetylierung von p53 Lysin 382 in NCI-H460-Zellen, erhöht aber signifikant die Menge an acetyliertem p53 in NCI-H460-Zellen, menschlichen Brustepithelzellen, U-2 OS und MCF-7-Zellen, die genotoxischen Substanzen wie Wasserstoffperoxid ausgesetzt sind, was effektiver ist als das, was durch Nicotinamid (5 mM) verursacht wird. Überraschenderweise führt es nicht zu nachweisbaren Auswirkungen auf die p53-kontrollierte Genexpression, das Überleben der Zellen oder die Zellproliferation. Es führt zu einem Anstieg der Zellzahl von HCT116-Zellen um 90 % nach 7 Tagen unter der Bedingung von 0,1 % Serum, aber nicht von 10 % Serum, was darauf hindeutet, dass SIRT1 ein signifikanter Regulator der Zellproliferation unter Wachstumsfaktor-Mangelbedingungen ist. Zusätzlich hebt es die Resveratrol-Effekte auf Glukose-Antworten auf und verhindert die Resveratrol-induzierte Hochregulierung von Glut2, Glukokinase, Pdx-1 und Tfam in INS-1E-Zellen, aufgrund des gegenteiligen Effekts von EX 527 und Resveratrol auf die SIRT1-Deacetylase-Aktivität. |
| Kinase-Assay |
Hemmung der GST-SIRT1-Deacetylase-Aktivität
|
|
293T-Zellen werden transient mit GST-markiertem humanem SIRT1 im pDEST27 Gateway-Vektor unter Verwendung von FuGENE-6 transfiziert. Nach 48 Stunden werden die Zellen mit 50 mM Tris, pH 8,0, 120 mM NaCl, 1 mM EDTA und 0,5 % Nonidet P-40, ergänzt mit Complete Mini Protease-Inhibitor-Cocktail-Tabletten, lysiert. GST-SIRT1 wird aus den Lysaten gereinigt und ausgiebig in dem oben genannten Puffer gewaschen. Der Deacetylierungs-Assay wird mit etwa 30 ng GST-SIRT1 in Gegenwart von Selisistat (EX 527) (48 pM bis 100 μM) durchgeführt. Die Deacetylierung wird mit dem Fluor de Lys-Kit unter Verwendung eines fluorogenen Peptids gemessen, das die Reste 379 bis 382 von p53 umfasst, acetyliert an Lysin 382. Der acetylierte Lysinrest ist an eine Aminomethylcoumarin-Einheit gekoppelt. Das Peptid wird durch SIRT1 deacetyliert, gefolgt von der Zugabe eines proteolytischen Entwicklers, der das fluoreszierende Aminomethylcoumarin freisetzt. Kurz gesagt, Enzympräparate werden mit 170 μM NAD+ und 100 μM p53 fluorogenem Peptid 45 Minuten bei 37 °C inkubiert, gefolgt von einer Inkubation im Entwickler für 15 Minuten bei 37 °C. Die Fluoreszenz wird durch Anregung bei 360 nm und Emission bei 460 nm gemessen und die enzymatische Aktivität wird in relativen Fluoreszenzeinheiten ausgedrückt.
|
|
| In vivo |
Die Verabreichung von Selisistat (EX 527; ~10 μg) an Ratten erhöht die hypothalamischen Acetyl-p53-Spiegel durch Hemmung der hypothalamischen SIRT1-Aktivität. Die gleichzeitige Verabreichung dieser Verbindung mit Ghrelin dämpft die orexigene Wirkung von Ghrelin deutlich, indem sie die pAMPK-Spiegel senkt, die ACC-Spiegel erhöht und die höhere Expression der Transkriptionsfaktoren FoxO1, pCREB und Bsx sowie der Neuropeptide NPY und AgRP im hypothalamischen Nucleus arcuatus aufhebt. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
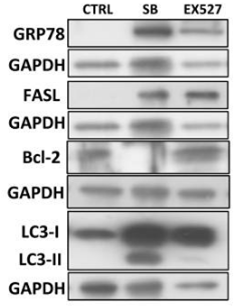
| Western blot | GRP78 / FASL / Bcl-2 / LC3 Ac-H3K9 / Fibronectin / Collagen 1 / α-SMA PCNA / Cyclin D1 / Cyclin E pEGFR / EGFR / pPDGFRβ / PDGFRβ pSTAT3 / STAT3 p27 FOXO3a / SIRT1 / Ac-p53 / p16(INK4a) |
|
29312612 |
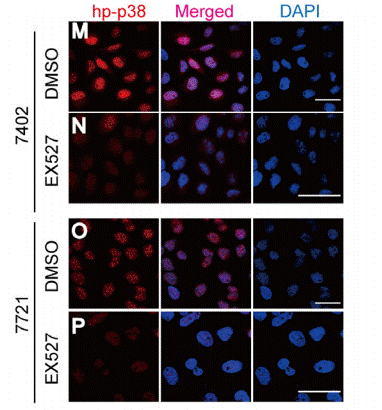
| Immunofluorescence | p-p38 |
|
26824501 |
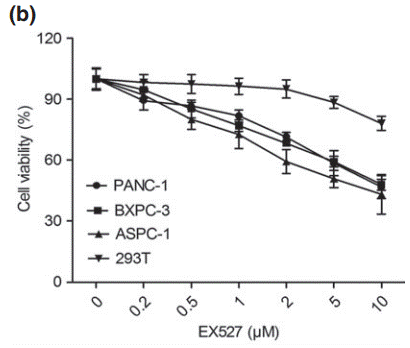
| Growth inhibition assay | Cell viability |
|
24484175 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01485965 | Completed | Huntington''s Disease |
Siena Biotech S.p.A. |
November 2011 | Phase 1 |
| NCT01521832 | Completed | Huntington''s Disease |
Siena Biotech S.p.A. |
October 2009 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
what is the extinction coefficient of it?
Antwort:
Its extinction coefficient is 1421.650635.
