nur für Forschungszwecke
ASP2215 (Gilteritinib) FLT3/AXL-Inhibitor
Kat.-Nr.S7754
Chemische Struktur
Molekulargewicht: 552.71
Qualitätskontrolle
Produkte, die oft zusammen verwendet werden mit ASP2215 (Gilteritinib)
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R HER2 c-Kit |
|---|---|
| Weitere FLT3 Inhibitoren | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Dovitinib (TKI258) Lactate monohydrate Tandutinib (MLN518) KW-2449 ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| MV4-11 cells | Cell cycle assay | 1, 3, 10, and 30 nM | 24 h | The mean proportion of MV4-11 cells in G1 phase were significantly increased at gilteritinib concentrations of 3 (69.0%; P<0.01) and 10 nM (70.7%; P<0.001). | 31069015 | |
| MOLM-13 cells | Apoptosis assay | 1, 3, 10, 30, and 100 nM | 48 h | significant increases in the percentage of annexin V-positive cells at concentrations of 30 nM (32.0%) and 100 nM (52.4%) versus control (4.1%) | 31069015 | |
| 32D/TKD cells | Function assay | 50 nM | 6 h | Inhibiton of the phosphorylation of Akt on T308 | 29507660 | |
| TF-1 cells | Function assay | 0, 20, 80, 200 and 500 nM | 1 h | gilteritinib has an IC50 against wild-type c-Kit of 102 nM | 27908881 | |
| BA/F3 | Function assay | Inhibition Assay: A recombinant retrovirus was created from expression plasmid FLAG-EML4-ALKv1/pMX-iresCD8 in which cDNA for EMLA-ALK fusion protein v1 was integrated, and injected into mouse lymphoid cell line BA/F3 cells. Using a magnetic bead reagent f, IC50 = 0.0015 μM. | ChEMBL | |||
| BA/F3 | Function assay | Inhibition Assay: A recombinant retrovirus was created from expression plasmid FLAG-EML4-ALKv1/pMX-iresCD8 in which cDNA for EMLA-ALK fusion protein v1 was integrated, and injected into mouse lymphoid cell line BA/F3 cells. Using a magnetic bead reagent f, IC50 = 0.0015 μM. | ChEMBL | |||
| Vero | Antiviral assay | 24 hr | Antiviral activity against SARS-CoV-2 (viral titer) measured by plaque assay in Vero cells at MOI 0.0125 after 24 hr, IC50 = 6.76 μM. | ChEMBL | ||
| Vero | Cell viability assay | 72 hr | Cell viability measured by CellTiter-Glo assay in Vero cells at MOI 0.05 after 72hr, CC50 = 37.16 μM. | ChEMBL | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 552.71 | Formel | C29H44N8O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1254053-43-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CCC1=C(N=C(C(=N1)C(=O)N)NC2=CC(=C(C=C2)N3CCC(CC3)N4CCN(CC4)C)OC)NC5CCOCC5 | ||
Löslichkeit
|
In vitro |
DMSO
: 4 mg/mL
(7.23 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
FLT3
(Cell-free assay) 0.29 nM
Axl
(Cell-free assay) 0.73 nM
|
|---|---|
| In vitro |
Gilteritinib (ASP2215) zeigt eine potente hemmende Aktivität gegen die interne Tandemduplikation (FLT3-ITD) und die FLT3-D835Y-Punktmutationen in zellulären Assays unter Verwendung von MV4-11- und MOLM-13-Zellen sowie Ba/F3-Zellen, die mutiertes FLT3 exprimieren. Es verringert die Phosphorylierungsspiegel von FLT3 und seinen nachgeschalteten Zielen sowohl in zellulären als auch in Tiermodellen. Diese Verbindung hemmt die Aktivität von acht der 78 getesteten Kinasen um über 50 % bei Konzentrationen von entweder 1 nM (FLT3, LTK, ALK und AXL) oder 5 nM (TRKA, ROS, RET und MER). Die Behandlung damit über 48 Stunden führt zu einer Induktion der Apoptose in MV4-11-Zellen, bestimmt durch einen Anstieg annexin V-positiver Zellen. Es verringert auch die Expression anti-apoptotischer Proteine wie MCL-1, BCL2L10 und Survivin, die Berichten zufolge wichtig für die Chemotherapieempfindlichkeit sind, nach 24-stündiger Behandlung.
|
| In vivo |
In vivo wird Gilteritinib (ASP2215) nach oraler Verabreichung in hohen Konzentrationen in xenotransplantierten Tumoren verteilt. Die verringerte FLT3-Aktivität und die hohe intratumorale Verteilung dieser Verbindung führen zu einer Tumorregression und einem verbesserten Überleben in Xenograft- und Intra-Knochenmarktransplantationsmodellen von FLT3-getriebener AML. Diese Antitumoraktivität ist mit einer dauerhaften Hemmung von Phospho-FLT3 und Phospho-STAT5 verbunden. Darüber hinaus verringert die Behandlung damit die leukämische Belastung und verlängert das Überleben in einem Maus-IBMT-Modell. In mit Gilteritinib behandelten Mausmodellen wurde keine offensichtliche Toxizität festgestellt.
|
Literatur |
|
Anwendungen
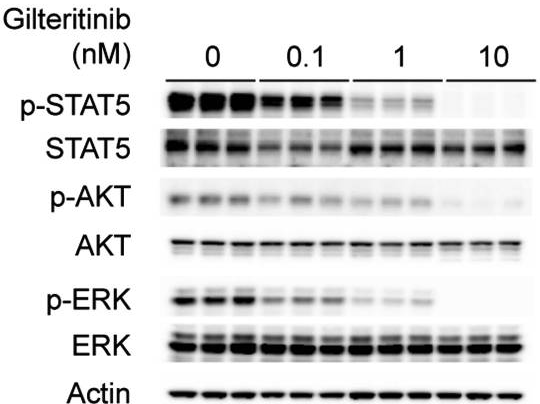
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | p-STAT5 / STAT5 / p-AKT / AKT / p-ERK / ERK p-c-kit / c-kit p-FLT3(Y591) / FLT3 |
|
28516360 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06022003 | Recruiting | AML Adult|Refractory AML|Relapsed Adult AML|FLT3-TKD Mutation|FLT3-ITD |
French Innovative Leukemia Organisation|Acute Leukemia French Association |
January 13 2024 | Phase 2 |
| NCT05520567 | Recruiting | Acute Myeloid Leukemia (AML)|FLT3-mutated Acute Myeloid Leukemia |
Astellas Pharma Global Development Inc.|Astellas Pharma Inc |
January 27 2023 | Phase 1|Phase 2 |
| NCT05791890 | Active not recruiting | Acute Myeloid Leukemia |
University of Rome Tor Vergata |
May 31 2022 | -- |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
